よむ、つかう、まなぶ。
08 参考資料1-2 沈降ヘモフィルスb型ワクチンファクトシート[2.4MB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34803.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第20回 8/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
⑤-5. VaxemHib と同成分を含む 5 種混合ワクチン Quinvaxem の安全性に関する検討
5 種混合ワクチン製剤(ジフテリア、破傷風、百日咳、Hib 感染症、ならびに B 型肝
炎)である Quinvaxem は Hib 抗原として VaxemHib と同じ組成の Hib オリゴ糖−CRM197 を
含む。ベトナムでは 2010 年から Quinvaxem が使用されていたが、2012 年 10 月から 2013
年 3 月に複数の接種後死亡例が報告され、一時的に接種を中止した。しかし、WHO によ
る検討の結果、致死的ではない有害事象 9 例に関しては Quinvaxem ワクチンとの因果関
係が認められるものの、死亡例を含む重篤な有害事象に関しては Quinvaxem ワクチン接
種との因果関係は立証されなかった(58)。
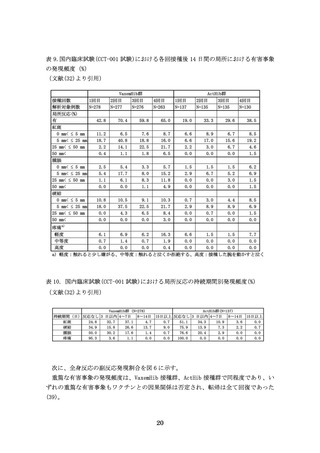
ベトナムで実施された Quinvaxem の臨床研究(n=131)では、11 例の重篤な有害事象
(上
気道炎や肺炎: 7 例、ウイルス感染症:3 例、感染性腸炎による下痢:1 例)はいずれ
も Quinvaxem の接種と因果関係は無いと報告された(59)。また、Quinvaxem の 3 ロット
間の比較を行った臨床研究において、ロット A 接種群(n=119)、ロット B 接種群(n=120)、
ロット C 接種群(n=121)における有害事象の発現頻度は、それぞれロット A 17.6%、ロ
ット B 24.2%、ロット C 25.6%であり、ロット間で大きな差は認められなかった(60)。
5. 医療経済学的効果
VaxemHib 接種の費用対効果を検討した論文を PubMed および医学中央雑誌を用いて
検索を行ったが、国内外ともに該当する論文は見つからなかった(2016 年 11 月現在)。
ActHib と VaxemHib の有効性および安全性に関しては、前述のごとく直接比較可能なデ
ータは限られている。仮に両者の有効性と安全性がほぼ同等であることが確認された場
合には、両者の価格差が大きければより安価なものを使用することが経済的と言える。
6. 接種方法・スケジュール
① 日本国内の接種スケジュール
日本国内では 2013 年 4 月 1 日より乾燥ヘモフィルスb型ワクチン(以下、ActHib)が
定期接種ワクチンとして導入されている。
ActHib の標準的な接種スケジュールは、
(1)初回接種開始時に生後 2 月から生後 7 月に至るまでの間にある者
初回接種については 27 日(医師が必要と認めた場合には 20 日)以上、
標準的には 27 日(医師が必要と認めた場合には 20 日)から 56 日までの
間隔をおいて 3 回、追加接種については初回接種終了後7月以上、標準的に
は 7 月から 13 月までの間隔をおいて 1 回行う。ただし、初回 2 回目及び 3
回目の接種は、生後 12 月に至るまでに行うこととし、それを超えた場合は行
わない。この場合、追加接種は実施可能であるが、初回接種に係る最後の注
射終了後、27 日(医師が必要と認めた場合には 20 日)以上の間隔をおいて
24
5 種混合ワクチン製剤(ジフテリア、破傷風、百日咳、Hib 感染症、ならびに B 型肝
炎)である Quinvaxem は Hib 抗原として VaxemHib と同じ組成の Hib オリゴ糖−CRM197 を
含む。ベトナムでは 2010 年から Quinvaxem が使用されていたが、2012 年 10 月から 2013
年 3 月に複数の接種後死亡例が報告され、一時的に接種を中止した。しかし、WHO によ
る検討の結果、致死的ではない有害事象 9 例に関しては Quinvaxem ワクチンとの因果関
係が認められるものの、死亡例を含む重篤な有害事象に関しては Quinvaxem ワクチン接
種との因果関係は立証されなかった(58)。
ベトナムで実施された Quinvaxem の臨床研究(n=131)では、11 例の重篤な有害事象
(上
気道炎や肺炎: 7 例、ウイルス感染症:3 例、感染性腸炎による下痢:1 例)はいずれ
も Quinvaxem の接種と因果関係は無いと報告された(59)。また、Quinvaxem の 3 ロット
間の比較を行った臨床研究において、ロット A 接種群(n=119)、ロット B 接種群(n=120)、
ロット C 接種群(n=121)における有害事象の発現頻度は、それぞれロット A 17.6%、ロ
ット B 24.2%、ロット C 25.6%であり、ロット間で大きな差は認められなかった(60)。
5. 医療経済学的効果
VaxemHib 接種の費用対効果を検討した論文を PubMed および医学中央雑誌を用いて
検索を行ったが、国内外ともに該当する論文は見つからなかった(2016 年 11 月現在)。
ActHib と VaxemHib の有効性および安全性に関しては、前述のごとく直接比較可能なデ
ータは限られている。仮に両者の有効性と安全性がほぼ同等であることが確認された場
合には、両者の価格差が大きければより安価なものを使用することが経済的と言える。
6. 接種方法・スケジュール
① 日本国内の接種スケジュール
日本国内では 2013 年 4 月 1 日より乾燥ヘモフィルスb型ワクチン(以下、ActHib)が
定期接種ワクチンとして導入されている。
ActHib の標準的な接種スケジュールは、
(1)初回接種開始時に生後 2 月から生後 7 月に至るまでの間にある者
初回接種については 27 日(医師が必要と認めた場合には 20 日)以上、
標準的には 27 日(医師が必要と認めた場合には 20 日)から 56 日までの
間隔をおいて 3 回、追加接種については初回接種終了後7月以上、標準的に
は 7 月から 13 月までの間隔をおいて 1 回行う。ただし、初回 2 回目及び 3
回目の接種は、生後 12 月に至るまでに行うこととし、それを超えた場合は行
わない。この場合、追加接種は実施可能であるが、初回接種に係る最後の注
射終了後、27 日(医師が必要と認めた場合には 20 日)以上の間隔をおいて
24