よむ、つかう、まなぶ。
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙1
患者申出療養評価会議事務局からの確認事項に対する回答
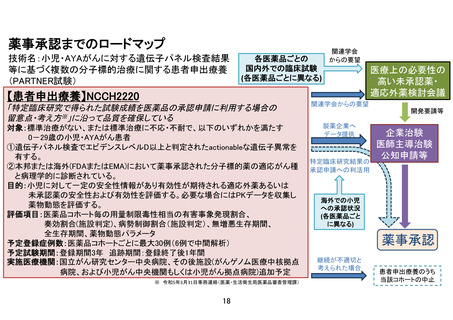
患者申出療養技術名:小児・AYA がんに対する遺伝子パネル検査結果等に基づく
複数の分子標的治療に関する患者申出療養
令和 5 年 8 月 24 日
所属:国立がん研究センター中央病院 小児腫瘍科
氏名:小川 千登世
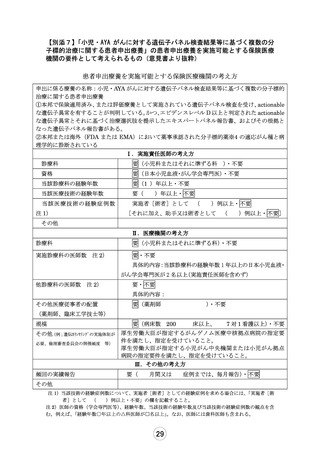
1.治験・拡大治験や先進医療といった他の制度で本技術が実施できない理由について説明してくだ
さい。
【回答】
参加可能な治験や臨床試験が極めて少ない小児がん患者では、海外で有効性が報告された医薬品
の適応外使用や未承認薬の患者家族による個人輸入をも含めた使用がなされることも少なくありませ
ん。本技術は、安全性に対する大きな不安も抱えながら未承認薬を個人輸入して使用せざるを得なかっ
た患者家族からの「保険適用されていない薬を使用しなければならないのであれば、医師の管理の下で
安心して使いたい」という声や、使いたかった未承認薬を個人輸入したにもかかわらず薬が届く前に亡く
なった患者の家族の「自分の子どもの経験を他の子どもたちのために役立ててほしい」という多くの要望
などに基づき立案しました。多くの分子標的薬で、国内小児における用法・用量が承認されていないこと
から、現状の患者申出療養技術でも小児で使用可能な薬剤は限定的となっています。遺伝子パネル検
査で有効性が期待できる薬剤が見つかり患者・家族から要望があっても、各々の薬剤について治験や
先進医療の計画・実施にかかる期間や、患者・家族のニーズに応じて対象とする医薬品を増やすことの
難しさを考慮すると、国内の小児がん患者が必要としている医薬品を幅広く迅速に届けることが最も優
先すべき課題であると考え、患者申出療養制度に基づいて試験を行う必要があると考えました。
治験・拡大治験または先進医療制度での実施を検討しましたが、現時点では下記理由により治験・拡
大治験あるいは先進医療として早期に実施することは難しいと判断しております。
・ 各医薬品において、拡大治験の対象となる、小児を対象とした主たる治験の実施中(登録終了)ま
たは実施後の状況でないこと。
・ 各医薬品において、小児における企業治験を実施する予定がないこと。
・ 各医薬品において、品質が確保された医師主導治験を 1 試験ずつ実施するために必要となる運営
体制が、費用面や人的資源などの問題から実質的に取れないこと。
・ 小児がんは症例数が少ないため、各医薬品において、治験のみならず、先進医療の枠組みでも、
統計学的根拠や実施可能性をもって有効性をエンドポイントとして設定可能でないこと。
本技術で安全性および有効性に係るデータを収集し、今後必要に応じて将来的な企業治験や医師主
導治験の実施、国際共同での開発や海外データ等も利用した開発などにつなげたいと考えております。
1
患者申出療養評価会議事務局からの確認事項に対する回答
患者申出療養技術名:小児・AYA がんに対する遺伝子パネル検査結果等に基づく
複数の分子標的治療に関する患者申出療養
令和 5 年 8 月 24 日
所属:国立がん研究センター中央病院 小児腫瘍科
氏名:小川 千登世
1.治験・拡大治験や先進医療といった他の制度で本技術が実施できない理由について説明してくだ
さい。
【回答】
参加可能な治験や臨床試験が極めて少ない小児がん患者では、海外で有効性が報告された医薬品
の適応外使用や未承認薬の患者家族による個人輸入をも含めた使用がなされることも少なくありませ
ん。本技術は、安全性に対する大きな不安も抱えながら未承認薬を個人輸入して使用せざるを得なかっ
た患者家族からの「保険適用されていない薬を使用しなければならないのであれば、医師の管理の下で
安心して使いたい」という声や、使いたかった未承認薬を個人輸入したにもかかわらず薬が届く前に亡く
なった患者の家族の「自分の子どもの経験を他の子どもたちのために役立ててほしい」という多くの要望
などに基づき立案しました。多くの分子標的薬で、国内小児における用法・用量が承認されていないこと
から、現状の患者申出療養技術でも小児で使用可能な薬剤は限定的となっています。遺伝子パネル検
査で有効性が期待できる薬剤が見つかり患者・家族から要望があっても、各々の薬剤について治験や
先進医療の計画・実施にかかる期間や、患者・家族のニーズに応じて対象とする医薬品を増やすことの
難しさを考慮すると、国内の小児がん患者が必要としている医薬品を幅広く迅速に届けることが最も優
先すべき課題であると考え、患者申出療養制度に基づいて試験を行う必要があると考えました。
治験・拡大治験または先進医療制度での実施を検討しましたが、現時点では下記理由により治験・拡
大治験あるいは先進医療として早期に実施することは難しいと判断しております。
・ 各医薬品において、拡大治験の対象となる、小児を対象とした主たる治験の実施中(登録終了)ま
たは実施後の状況でないこと。
・ 各医薬品において、小児における企業治験を実施する予定がないこと。
・ 各医薬品において、品質が確保された医師主導治験を 1 試験ずつ実施するために必要となる運営
体制が、費用面や人的資源などの問題から実質的に取れないこと。
・ 小児がんは症例数が少ないため、各医薬品において、治験のみならず、先進医療の枠組みでも、
統計学的根拠や実施可能性をもって有効性をエンドポイントとして設定可能でないこと。
本技術で安全性および有効性に係るデータを収集し、今後必要に応じて将来的な企業治験や医師主
導治験の実施、国際共同での開発や海外データ等も利用した開発などにつなげたいと考えております。
1