よむ、つかう、まなぶ。
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
的薬の同定. 日本小児血液・がん学会雑誌(2187-011X)59 巻 4 号 Page 223(2022.10)
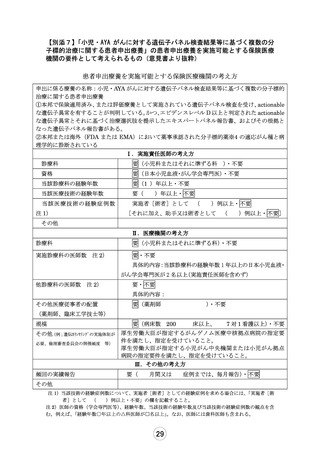
2.治験においてではありますが代諾者(原則親権者・・・)に対する製薬協の見解として、
「GCP では、両親(2 人)からの同意を得る必要があるか否かについては規定されていません。したが
って、十分な説明を受けた一方の親(1 人)からの同意取得でも差支えないと考えます。ただし、親権
者間での意思の齟齬が生じないよう、両親ともに納得したことを治験責任医師等が確認した後に、
同意書へ署名されることが望ましいと考えます。」
が公表されています。この文章の後半部分を担保する手段として何か工夫することは可能でしょう
か?たとえば、説明文書中に≪研究に参加する未成年の被験者の父母が婚姻中である場合には、
十分に話し合って両親ともに治験の参加に対して見解を一致させた上で、同意書の代諾者欄にご署
名ください≫といった趣旨の文を加えるとか。後日署名しなかった片親(親権者)からクレームがくる
リスクはないでしょうか(とくに不幸な転帰となった場合)。
【回答】
患者さんが安心・安全に試験治療を受ける上で、親権者間で意思の齟齬が生じないことは重要な点でご
ざいますが、「親権者が未成年の患者の意思や利益を十分に相談し合意した上で、試験参加や治療に
同意頂くことが望ましい」ことは、未成年者の治験や臨床試験参加の際のみならず、未成年者の診療全
般に関わる医師だれもが心得ている事項であると考えております。同意書に署名を頂くにあたっては、
できる限りすべての代諾者が医師から直接説明をうけ、直接説明を聞くことが難しい場合でも説明同意
文書を読んでいただくなどののち、責任医師・分担医師が両親いずれもの同意を確認した上で、同意書
に署名を頂くことを原則としております。本研究におきましても、説明・同意取得の際は、原則として上記
のプロセスを取り、納得した上で同意書に署名を頂くように致します。しかしながら、法的な婚姻関係が
解消していない場合でも、必ずしも両親が同じ様に患者の意思や最善の利益を優先して考えられうると
は限らない状況などもあり、説明文書に両親二人の合意が必須とまでは記載しなくてよいと考えます。
今後、本研究が多施設化した場合におきましても、参加施設は全て小児がん中央機関または小児がん
拠点病院であり、未成年者の診療の経験が十分にある医師が診療を担当するため、原則として両親の
合意を確認する必要性については認識されているものと考えます。
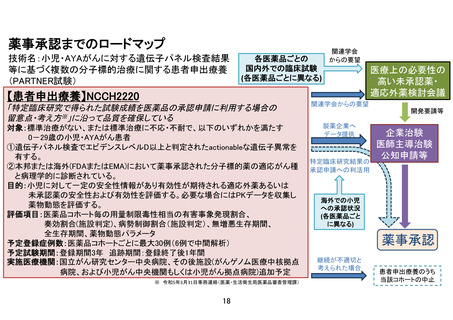
3.本研究においては AMED 研究資金も併用して薬物動態データを集め、さらにこの研究後に企業治
験または医師主導治験が予定されている(保険適応取得のために必要となる)と理解しています。か
なり専門的な話にはなりますが、このことを説明文書・同意書に記載しなくてもよいでしょうか?
【回答】
薬物動態解析を行う薬剤については、当該薬剤の説明文書・同意書に記載しており、患者の同意のもと
で実施することにしています。また、本研究は、医薬品の適応拡大などに利活用可能な形で情報を収集
することも目的としていますが、利活用の方法としては、本研究で得られたデータを参考に企業治験や
医師主導治験を立案する他、「医療上の必要性の高い未承認薬・適応外薬検討会議」に提出し公知申
請を目指す方法、さらに、「特定臨床研究で得られた試験成績を医薬品の承認申請に利用する場合の
留意点・考え方の例示について」(令和 4 年 3 月事務連絡)に沿って特定臨床研究(本研究)で得られた
試験成績を承認申請に利用する方法、などが考えられます。現時点で企業治験や医師主導治験の予
5
2.治験においてではありますが代諾者(原則親権者・・・)に対する製薬協の見解として、
「GCP では、両親(2 人)からの同意を得る必要があるか否かについては規定されていません。したが
って、十分な説明を受けた一方の親(1 人)からの同意取得でも差支えないと考えます。ただし、親権
者間での意思の齟齬が生じないよう、両親ともに納得したことを治験責任医師等が確認した後に、
同意書へ署名されることが望ましいと考えます。」
が公表されています。この文章の後半部分を担保する手段として何か工夫することは可能でしょう
か?たとえば、説明文書中に≪研究に参加する未成年の被験者の父母が婚姻中である場合には、
十分に話し合って両親ともに治験の参加に対して見解を一致させた上で、同意書の代諾者欄にご署
名ください≫といった趣旨の文を加えるとか。後日署名しなかった片親(親権者)からクレームがくる
リスクはないでしょうか(とくに不幸な転帰となった場合)。
【回答】
患者さんが安心・安全に試験治療を受ける上で、親権者間で意思の齟齬が生じないことは重要な点でご
ざいますが、「親権者が未成年の患者の意思や利益を十分に相談し合意した上で、試験参加や治療に
同意頂くことが望ましい」ことは、未成年者の治験や臨床試験参加の際のみならず、未成年者の診療全
般に関わる医師だれもが心得ている事項であると考えております。同意書に署名を頂くにあたっては、
できる限りすべての代諾者が医師から直接説明をうけ、直接説明を聞くことが難しい場合でも説明同意
文書を読んでいただくなどののち、責任医師・分担医師が両親いずれもの同意を確認した上で、同意書
に署名を頂くことを原則としております。本研究におきましても、説明・同意取得の際は、原則として上記
のプロセスを取り、納得した上で同意書に署名を頂くように致します。しかしながら、法的な婚姻関係が
解消していない場合でも、必ずしも両親が同じ様に患者の意思や最善の利益を優先して考えられうると
は限らない状況などもあり、説明文書に両親二人の合意が必須とまでは記載しなくてよいと考えます。
今後、本研究が多施設化した場合におきましても、参加施設は全て小児がん中央機関または小児がん
拠点病院であり、未成年者の診療の経験が十分にある医師が診療を担当するため、原則として両親の
合意を確認する必要性については認識されているものと考えます。
3.本研究においては AMED 研究資金も併用して薬物動態データを集め、さらにこの研究後に企業治
験または医師主導治験が予定されている(保険適応取得のために必要となる)と理解しています。か
なり専門的な話にはなりますが、このことを説明文書・同意書に記載しなくてもよいでしょうか?
【回答】
薬物動態解析を行う薬剤については、当該薬剤の説明文書・同意書に記載しており、患者の同意のもと
で実施することにしています。また、本研究は、医薬品の適応拡大などに利活用可能な形で情報を収集
することも目的としていますが、利活用の方法としては、本研究で得られたデータを参考に企業治験や
医師主導治験を立案する他、「医療上の必要性の高い未承認薬・適応外薬検討会議」に提出し公知申
請を目指す方法、さらに、「特定臨床研究で得られた試験成績を医薬品の承認申請に利用する場合の
留意点・考え方の例示について」(令和 4 年 3 月事務連絡)に沿って特定臨床研究(本研究)で得られた
試験成績を承認申請に利用する方法、などが考えられます。現時点で企業治験や医師主導治験の予
5