よむ、つかう、まなぶ。
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
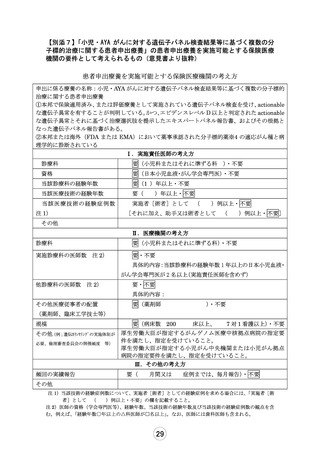
患者申出療養 実施計画等評価表
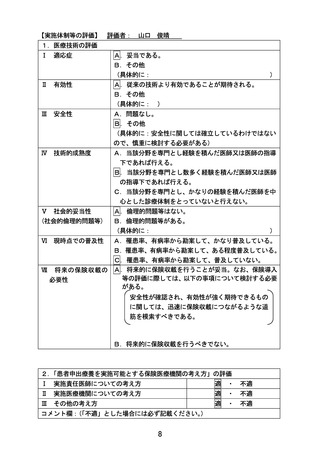
評価者
主担当:
副担当:
山口 俊晴
山崎 力、 上村 尚人
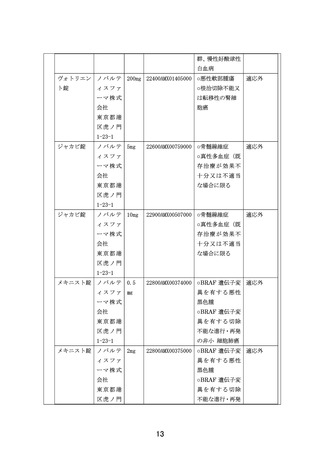
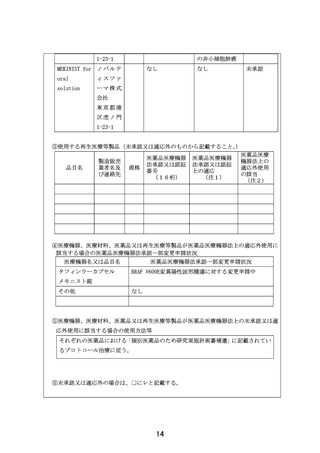
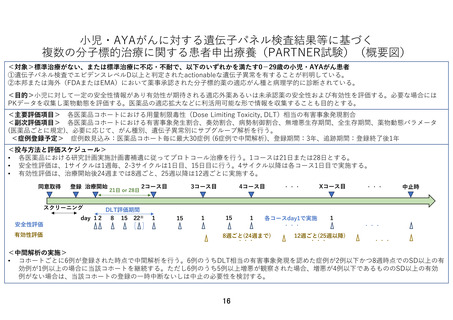
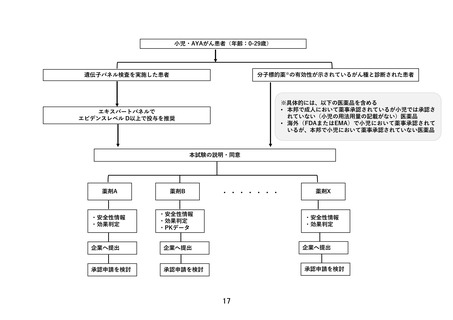
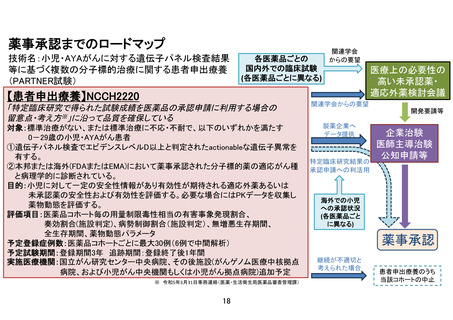
申 出 に 係 る 小児・AYA がんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関す
療 養 の 名 称 る患者申出療養
臨床研究中核
国立がん研究センター中央病院
病院の名称
実施医療機関
の名称
国立がん研究センター中央病院
(概要)
本研究は、患者申出療養制度に基づいて本研究に組み込まれている医薬品の投与を
希望する小児・AYA がん患者を対象に、小児における一定の安全性情報があり有効
性が期待される適応外薬あるいは未承認薬を投与し、安全性および有効性を評価す
るとともに、必要な場合には PK データを収集し薬物動態を評価することを目的と
して行う研究である。
本研究では保険適用が得られていない適応外医薬品もしくは未承認医薬品が用い
られる。そのため、患者申出療養制度に基づき、臨床研究法下で実施する特定臨床
研究に該当する。医薬品は契約に基づき製造販売業者から無償提供を受ける。医薬
品の無償提供を受けた場合、本研究で収集された患者背景や治療効果、安全性のデ
ータを、契約に基づき薬剤提供企業に提供することがあり得る。
本研究は、国立がん研究センター中央病院が研究代表医師および全体の調整事務局
医 療 技 術
の
概
要
を担い、がんゲノム医療中核拠点病院、かつ小児がん中央機関または小児がん拠点
病院を中心に、患者申出療養評価会議で協力医療機関として認められた施設が参加
して行う多施設共同研究である。
(効果)
予想される利益
患者申出療養制度に基づく本研究は、標準治療に対して抵抗性である、または標準
治療が存在しない患者を対象としており、本研究への参加により新規の治療選択肢
が増える。
予想される危険と不利益
医薬品の効果が十分得られない可能性、有害事象による苦痛を伴う可能性や予測さ
れなかった有害事象が起こる可能性、緩和ケアを十分に受ける機会を喪失する可能
性が考えられる。この不利益を含めて、本研究への参加時点で十分な患者説明を行
って同意を得る。
7
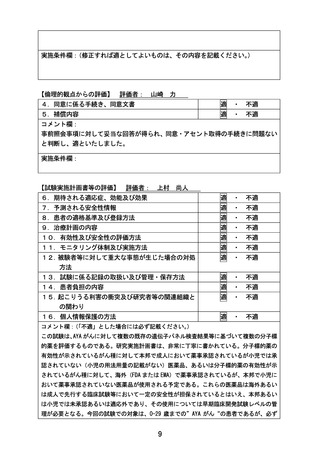
評価者
主担当:
副担当:
山口 俊晴
山崎 力、 上村 尚人
申 出 に 係 る 小児・AYA がんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関す
療 養 の 名 称 る患者申出療養
臨床研究中核
国立がん研究センター中央病院
病院の名称
実施医療機関
の名称
国立がん研究センター中央病院
(概要)
本研究は、患者申出療養制度に基づいて本研究に組み込まれている医薬品の投与を
希望する小児・AYA がん患者を対象に、小児における一定の安全性情報があり有効
性が期待される適応外薬あるいは未承認薬を投与し、安全性および有効性を評価す
るとともに、必要な場合には PK データを収集し薬物動態を評価することを目的と
して行う研究である。
本研究では保険適用が得られていない適応外医薬品もしくは未承認医薬品が用い
られる。そのため、患者申出療養制度に基づき、臨床研究法下で実施する特定臨床
研究に該当する。医薬品は契約に基づき製造販売業者から無償提供を受ける。医薬
品の無償提供を受けた場合、本研究で収集された患者背景や治療効果、安全性のデ
ータを、契約に基づき薬剤提供企業に提供することがあり得る。
本研究は、国立がん研究センター中央病院が研究代表医師および全体の調整事務局
医 療 技 術
の
概
要
を担い、がんゲノム医療中核拠点病院、かつ小児がん中央機関または小児がん拠点
病院を中心に、患者申出療養評価会議で協力医療機関として認められた施設が参加
して行う多施設共同研究である。
(効果)
予想される利益
患者申出療養制度に基づく本研究は、標準治療に対して抵抗性である、または標準
治療が存在しない患者を対象としており、本研究への参加により新規の治療選択肢
が増える。
予想される危険と不利益
医薬品の効果が十分得られない可能性、有害事象による苦痛を伴う可能性や予測さ
れなかった有害事象が起こる可能性、緩和ケアを十分に受ける機会を喪失する可能
性が考えられる。この不利益を含めて、本研究への参加時点で十分な患者説明を行
って同意を得る。
7