よむ、つかう、まなぶ。
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
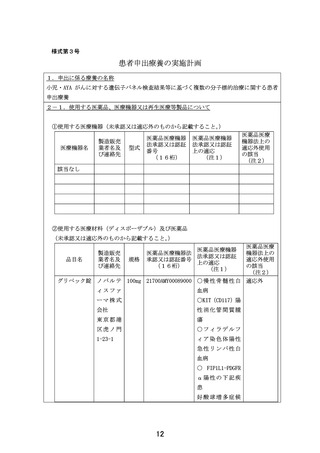
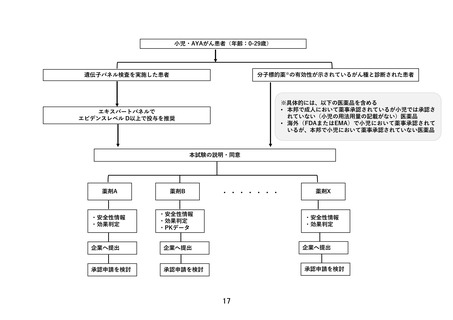
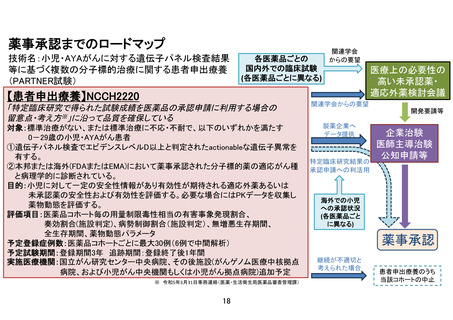
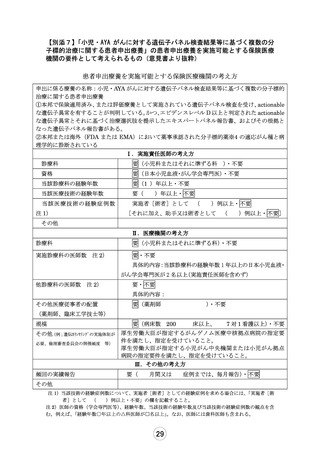
【別添6】「小児・AYA がんに対する遺伝子パネル検査結果等に基づく複数の分
子標的治療に関する患者申出療養」の治療計画(意見書より抜粋)
6.治療計画
化学療法
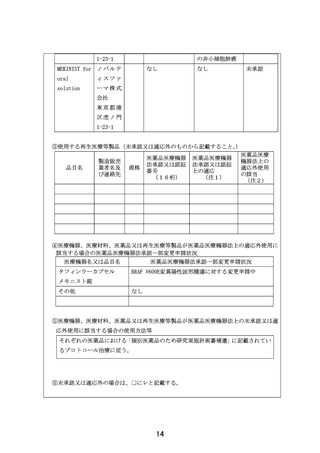
1)本試験で準備する医薬品
以下のいずれかに該当し、製薬企業の協力が得られる医薬品。
①エキスパートパネルで小児がんに対しエビデンスレベル D 以上で推奨されることが想定さ
れる医薬品
②分子標的薬の有効性が示されているがん種に対して、本邦で成人において薬事承認されてい
るが、小児では承認されていない(小児の用法用量の記載がない)医薬品
③分子標的薬の有効性が示されているがん種に対して、海外(FDA または EMA)で小児におい
て薬事承認されているが、本邦で小児において薬事承認されていない医薬品
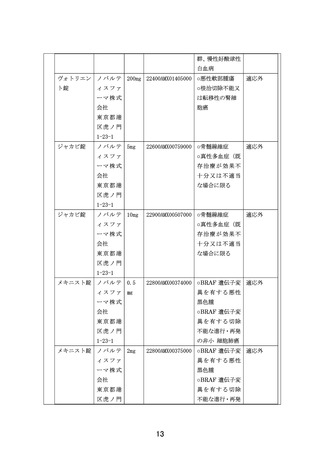
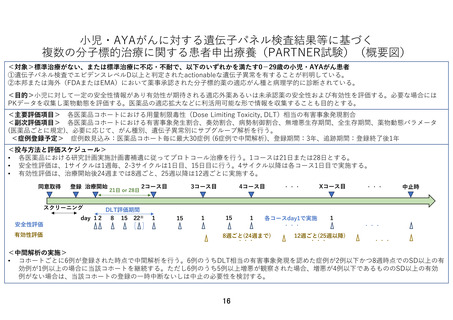
2)治療レジメン
各医薬品における DSA に従ってプロトコール治療を行う。1 コースは 21 日間または 28 日間と
する。研究実施計画書補遺で特に規定がない限り、薬剤添付文書で定められている成人の用法
用量を超えない。
薬剤添付文書において、他の医薬品との併用が認められている場合であっても、本研究におい
ては、プロトコールや研究実施計画書補遺等で規定されていない限り、他の抗悪性腫瘍薬との
併用は許容されない。他の医薬品との併用が認められているものを単剤で使用する場合にも研
究実施計画書補遺で規定された用法用量で行う。本研究において規定される、併用できる医薬
品の組み合わせは「研究実施計画書 付録 医薬品リスト」に従う。
各医薬品における、延期(投与間隔の延長、投与を規定より遅らせること)
、休止(条件を満
たせば再開する可能性のある一時的中断や休薬)等の変更、および支持療法や併用禁忌薬等は
本プロトコールと DSA に従う。また、薬剤添付文書および海外承認があるものについては海外
の薬剤添付文書を参照すること。
なお、既存の剤形のままでの内服が困難な患者で、懸濁での服用に安全性上の懸念がないと考
えられる場合には、日常診療に準じて服薬ゼリーの使用や懸濁での服用を許容する。詳細は各
DSA に規定する。また、国内未承認の小児用新剤型の使用の場合は DSA に記載する。
28
子標的治療に関する患者申出療養」の治療計画(意見書より抜粋)
6.治療計画
化学療法
1)本試験で準備する医薬品
以下のいずれかに該当し、製薬企業の協力が得られる医薬品。
①エキスパートパネルで小児がんに対しエビデンスレベル D 以上で推奨されることが想定さ
れる医薬品
②分子標的薬の有効性が示されているがん種に対して、本邦で成人において薬事承認されてい
るが、小児では承認されていない(小児の用法用量の記載がない)医薬品
③分子標的薬の有効性が示されているがん種に対して、海外(FDA または EMA)で小児におい
て薬事承認されているが、本邦で小児において薬事承認されていない医薬品
2)治療レジメン
各医薬品における DSA に従ってプロトコール治療を行う。1 コースは 21 日間または 28 日間と
する。研究実施計画書補遺で特に規定がない限り、薬剤添付文書で定められている成人の用法
用量を超えない。
薬剤添付文書において、他の医薬品との併用が認められている場合であっても、本研究におい
ては、プロトコールや研究実施計画書補遺等で規定されていない限り、他の抗悪性腫瘍薬との
併用は許容されない。他の医薬品との併用が認められているものを単剤で使用する場合にも研
究実施計画書補遺で規定された用法用量で行う。本研究において規定される、併用できる医薬
品の組み合わせは「研究実施計画書 付録 医薬品リスト」に従う。
各医薬品における、延期(投与間隔の延長、投与を規定より遅らせること)
、休止(条件を満
たせば再開する可能性のある一時的中断や休薬)等の変更、および支持療法や併用禁忌薬等は
本プロトコールと DSA に従う。また、薬剤添付文書および海外承認があるものについては海外
の薬剤添付文書を参照すること。
なお、既存の剤形のままでの内服が困難な患者で、懸濁での服用に安全性上の懸念がないと考
えられる場合には、日常診療に準じて服薬ゼリーの使用や懸濁での服用を許容する。詳細は各
DSA に規定する。また、国内未承認の小児用新剤型の使用の場合は DSA に記載する。
28