よむ、つかう、まなぶ。
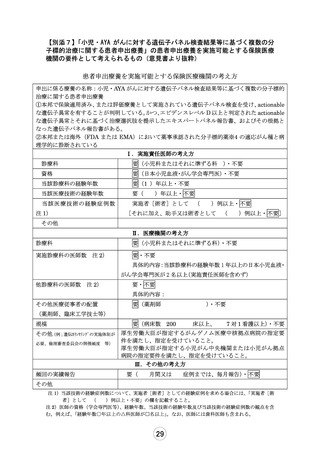
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
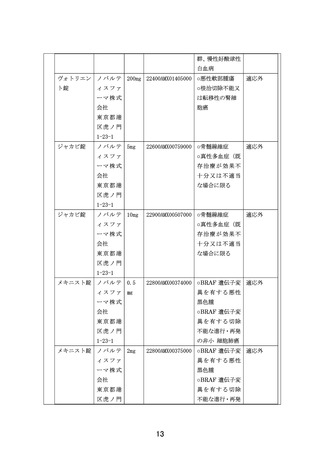
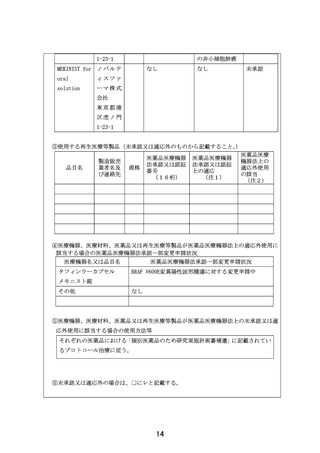
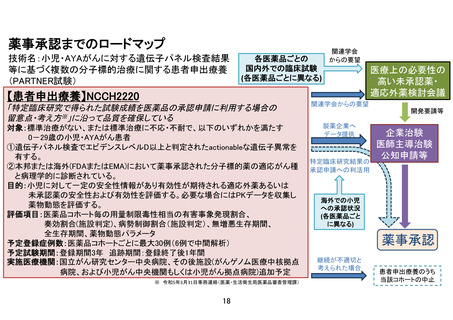
【別添5】「小児・AYA がんに対する遺伝子パネル検査結果等に基づく複数の分
子標的治療に関する患者申出療養」の予定の試験期間及び症例数(意見書より抜
粋)
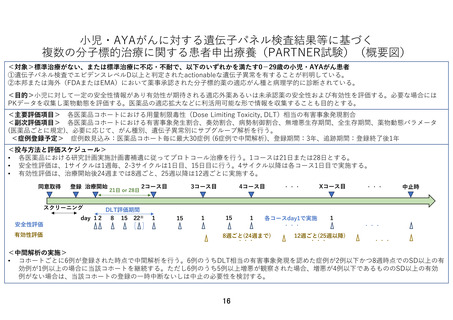
7-2.予定の試験期間及び症例数
予定登録期間:3 年(2024 年 1 月 1 日~2026 年 12 月 31 日)
追跡期間:登録終了後 1 年(2027 年 1 月 1 日~2027 年 12 月 31 日)
解析期間:1 年(2028 年 1 月 1 日~2028 年 12 月 31 日)
研究期間:5 年(2024 年 1 月 1 日~2028 年 12 月 31 日)
予定症例数:50 例(医薬品コホートごとに最大 30 例)
予定試験期間及び予定症例数の設定根拠:
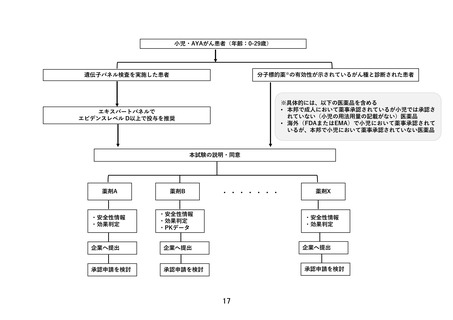
本研究では、臨床的仮説に基づいた登録数の設定は行わない。医薬品ごとに薬剤提供を受け
る製薬企業と国立がん研究センターとの間で契約を締結し、医薬品ごとに登録数に一定の上
限を設ける。この上限は、医薬品ごとにある程度の探索的な検討が可能になると考えられる
30 例を目安とする。
ただし、その上限に達する前であっても、有効ではない治療に対し漫然と薬剤投与が継続さ
れることは倫理的に許容されない。また、有効性・安全性に期待が持てる状況である場合に
は、当該医薬品の適応拡大・保険適用を目指すために早期に企業治験・医師主導治験等の計
画立案に繋げる必要がある。そのため、別途定める中間解析を行い、医薬品コホートごとに
無効中止を検討する decision rule を設けると共に、解析結果を企業に提供する。これによ
り、既存の治療法がなく他に対象となる治験等も実施されていない患者に対して有望な薬剤
を提供する枠組みを設けつつ、非倫理的な治療が継続されること、および、患者申出療養が
漫然と継続されることを回避する。
一方、上記登録例数の設定はあくまでも一定の評価を行うための設定であり、定期モニタリ
ング時の情報、中間解析結果、主たる解析結果等に基づき、製薬企業から薬剤提供の継続が
なされる場合には、適宜登録数変更の要否を検討し、患者申出療養会議に諮る。
本研究の予定登録期間は 3 年間とし、追跡期間は全患者の登録終了後 1 年間とする。予定登
録期間内に薬剤ごとに登録が開始され終了する。予定登録期間 3 年が終了する前に、適応外
薬の availability 等の社会情勢を鑑みて、登録期間を延長するプロトコールの内容変更を
行うかどうかを検討する。
本研究では複数の薬剤を同時に組み入れて実施するため、研究全体での年間登録数は組み入
れ薬剤数に依存する。
27
子標的治療に関する患者申出療養」の予定の試験期間及び症例数(意見書より抜
粋)
7-2.予定の試験期間及び症例数
予定登録期間:3 年(2024 年 1 月 1 日~2026 年 12 月 31 日)
追跡期間:登録終了後 1 年(2027 年 1 月 1 日~2027 年 12 月 31 日)
解析期間:1 年(2028 年 1 月 1 日~2028 年 12 月 31 日)
研究期間:5 年(2024 年 1 月 1 日~2028 年 12 月 31 日)
予定症例数:50 例(医薬品コホートごとに最大 30 例)
予定試験期間及び予定症例数の設定根拠:
本研究では、臨床的仮説に基づいた登録数の設定は行わない。医薬品ごとに薬剤提供を受け
る製薬企業と国立がん研究センターとの間で契約を締結し、医薬品ごとに登録数に一定の上
限を設ける。この上限は、医薬品ごとにある程度の探索的な検討が可能になると考えられる
30 例を目安とする。
ただし、その上限に達する前であっても、有効ではない治療に対し漫然と薬剤投与が継続さ
れることは倫理的に許容されない。また、有効性・安全性に期待が持てる状況である場合に
は、当該医薬品の適応拡大・保険適用を目指すために早期に企業治験・医師主導治験等の計
画立案に繋げる必要がある。そのため、別途定める中間解析を行い、医薬品コホートごとに
無効中止を検討する decision rule を設けると共に、解析結果を企業に提供する。これによ
り、既存の治療法がなく他に対象となる治験等も実施されていない患者に対して有望な薬剤
を提供する枠組みを設けつつ、非倫理的な治療が継続されること、および、患者申出療養が
漫然と継続されることを回避する。
一方、上記登録例数の設定はあくまでも一定の評価を行うための設定であり、定期モニタリ
ング時の情報、中間解析結果、主たる解析結果等に基づき、製薬企業から薬剤提供の継続が
なされる場合には、適宜登録数変更の要否を検討し、患者申出療養会議に諮る。
本研究の予定登録期間は 3 年間とし、追跡期間は全患者の登録終了後 1 年間とする。予定登
録期間内に薬剤ごとに登録が開始され終了する。予定登録期間 3 年が終了する前に、適応外
薬の availability 等の社会情勢を鑑みて、登録期間を延長するプロトコールの内容変更を
行うかどうかを検討する。
本研究では複数の薬剤を同時に組み入れて実施するため、研究全体での年間登録数は組み入
れ薬剤数に依存する。
27