よむ、つかう、まなぶ。
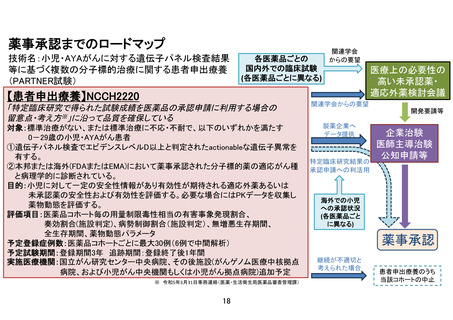
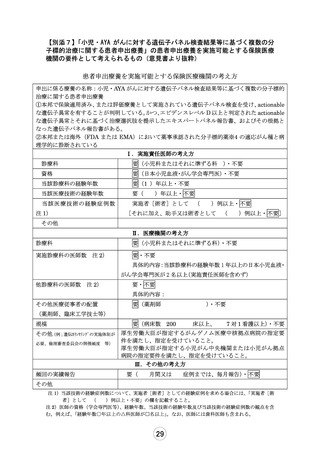
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
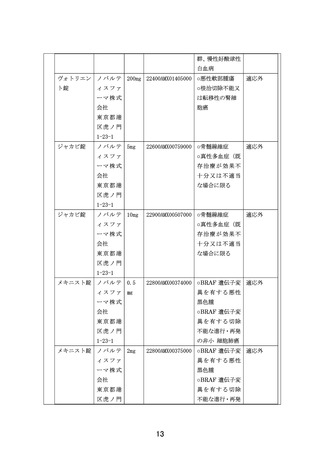
1-23-1
の非小細胞肺癌
MEKINIST for ノ バ ル テ
oral
ィスファ
solution
ーマ株式
なし
なし
未承認
会社
東京都港
区虎ノ門
1-23-1
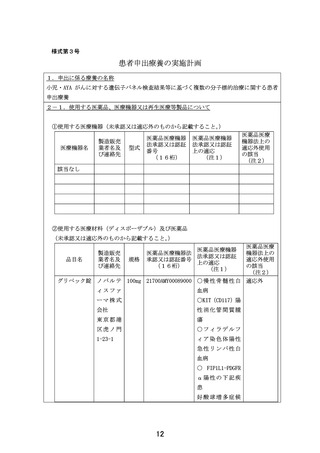
③使用する再生医療等製品(未承認又は適応外のものから記載すること。
)
医薬品医療
医薬品医療機器 医薬品医療機器
製造販売
機器法上の
法承認又は認証 法承認又は認証
品目名
業者名及 規格
適応外使用
番号
上の適応
び連絡先
の該当
(16桁)
(注1)
(注2)
④医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の適応外使用に
該当する場合の医薬品医療機器法承認一部変更申請状況
医療機器名又は品目名
タフィンラーカプセル
医薬品医療機器法承認一部変更申請状況
BRAF V600E変異陽性固形腫瘍に対する変更申請中
メキニスト錠
その他
なし
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適
応外使用に該当する場合の使用方法等
それぞれの医薬品における「個別医薬品のため研究実施計画書補遺」に記載されてい
るプロトコール治療に従う。
⑥未承認又は適応外の場合は、□にレと記載する。
14
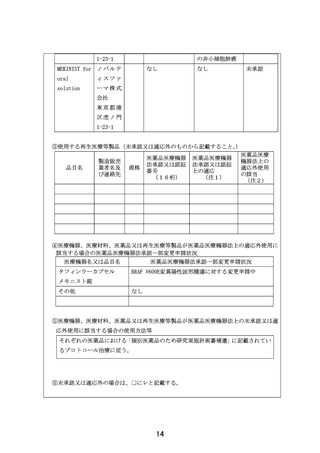
の非小細胞肺癌
MEKINIST for ノ バ ル テ
oral
ィスファ
solution
ーマ株式
なし
なし
未承認
会社
東京都港
区虎ノ門
1-23-1
③使用する再生医療等製品(未承認又は適応外のものから記載すること。
)
医薬品医療
医薬品医療機器 医薬品医療機器
製造販売
機器法上の
法承認又は認証 法承認又は認証
品目名
業者名及 規格
適応外使用
番号
上の適応
び連絡先
の該当
(16桁)
(注1)
(注2)
④医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の適応外使用に
該当する場合の医薬品医療機器法承認一部変更申請状況
医療機器名又は品目名
タフィンラーカプセル
医薬品医療機器法承認一部変更申請状況
BRAF V600E変異陽性固形腫瘍に対する変更申請中
メキニスト錠
その他
なし
⑤医療機器、医療材料、医薬品又は再生医療等製品が医薬品医療機器法上の未承認又は適
応外使用に該当する場合の使用方法等
それぞれの医薬品における「個別医薬品のため研究実施計画書補遺」に記載されてい
るプロトコール治療に従う。
⑥未承認又は適応外の場合は、□にレと記載する。
14