よむ、つかう、まなぶ。
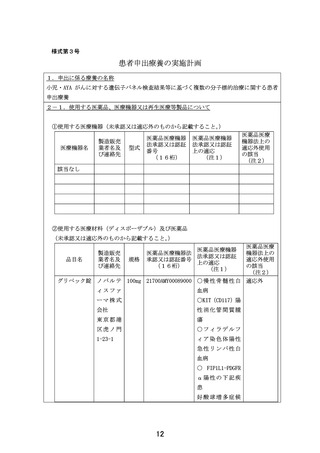
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
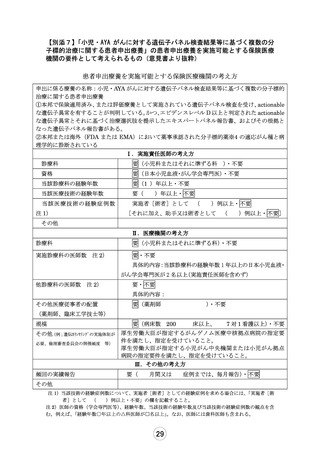
実施条件欄:
(修正すれば適としてよいものは、その内容を記載ください。
)
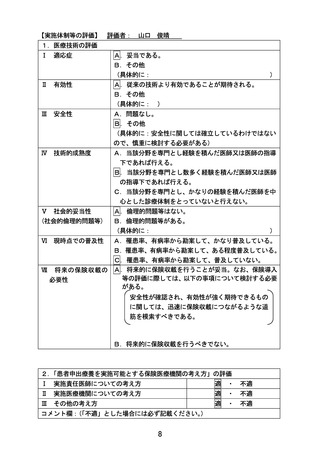
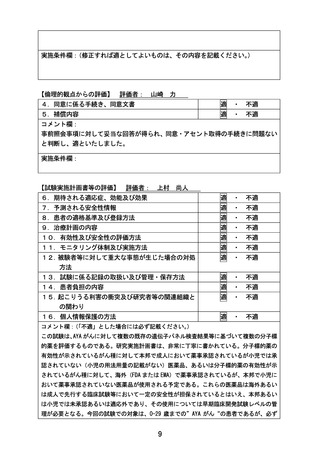
【倫理的観点からの評価】 評価者: 山崎 力
4.同意に係る手続き、同意文書
適 ・ 不適
5.補償内容
適 ・ 不適
コメント欄:
事前照会事項に対して妥当な回答が得られ、同意・アセント取得の手続きに問題ない
と判断し、適といたしました。
実施条件欄:
【試験実施計画書等の評価】 評価者: 上村 尚人
6.期待される適応症、効能及び効果
適 ・ 不適
7.予測される安全性情報
適 ・ 不適
8.患者の適格基準及び登録方法
適 ・ 不適
9.治療計画の内容
適 ・ 不適
10.有効性及び安全性の評価方法
適 ・ 不適
11.モニタリング体制及び実施方法
適 ・ 不適
12.被験者等に対して重大な事態が生じた場合の対処
方法
適 ・ 不適
13.試験に係る記録の取扱い及び管理・保存方法
適 ・ 不適
14.患者負担の内容
適 ・ 不適
15.起こりうる利害の衝突及び研究者等の関連組織と
の関わり
適 ・ 不適
16.個人情報保護の方法
適 ・ 不適
コメント欄:
(
「不適」とした場合には必ず記載ください。
)
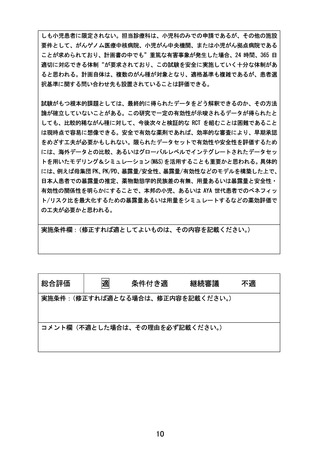
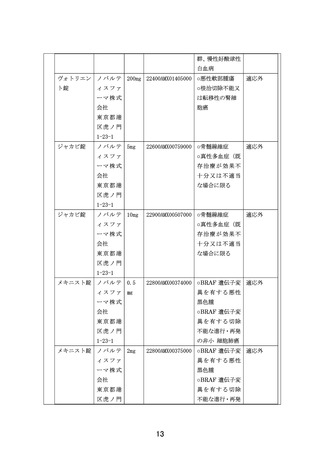
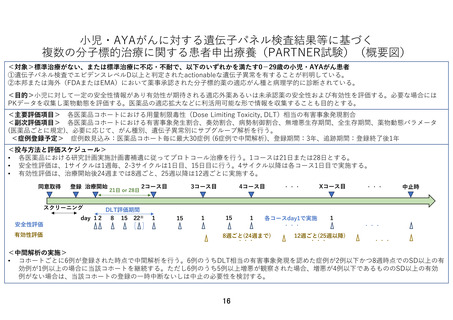
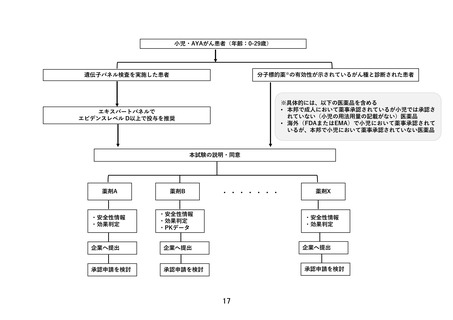
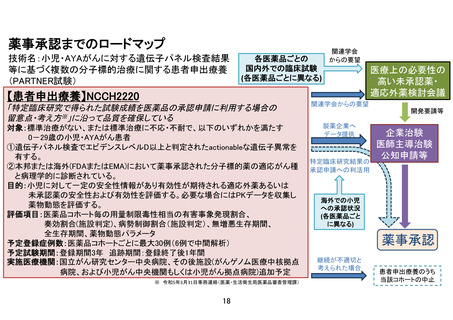
この試験は、AYA がんに対して複数の既存の遺伝子パネル検査結果等に基づいて複数の分子標
的薬を評価するものである。研究実施計画書は、非常に丁寧に書かれている。分子標的薬の
有効性が示されているがん種に対して本邦で成人において薬事承認されているが小児では承
認されていない(小児の用法用量の記載がない)医薬品、あるいは分子標的薬の有効性が示
されているがん種に対して、海外(FDA または EMA)で薬事承認されているが、本邦で小児に
おいて薬事承認されていない医薬品が使用される予定である。これらの医薬品は海外あるい
は成人で先行する臨床試験等において一定の安全性が担保されているとはいえ、本邦あるい
は小児では未承認あるいは適応外であり、その使用については早期臨床開発試験レベルの管
理が必要となる。今回の試験での対象は、0-29 歳までの”AYA がん“の患者であるが、必ず
9
(修正すれば適としてよいものは、その内容を記載ください。
)
【倫理的観点からの評価】 評価者: 山崎 力
4.同意に係る手続き、同意文書
適 ・ 不適
5.補償内容
適 ・ 不適
コメント欄:
事前照会事項に対して妥当な回答が得られ、同意・アセント取得の手続きに問題ない
と判断し、適といたしました。
実施条件欄:
【試験実施計画書等の評価】 評価者: 上村 尚人
6.期待される適応症、効能及び効果
適 ・ 不適
7.予測される安全性情報
適 ・ 不適
8.患者の適格基準及び登録方法
適 ・ 不適
9.治療計画の内容
適 ・ 不適
10.有効性及び安全性の評価方法
適 ・ 不適
11.モニタリング体制及び実施方法
適 ・ 不適
12.被験者等に対して重大な事態が生じた場合の対処
方法
適 ・ 不適
13.試験に係る記録の取扱い及び管理・保存方法
適 ・ 不適
14.患者負担の内容
適 ・ 不適
15.起こりうる利害の衝突及び研究者等の関連組織と
の関わり
適 ・ 不適
16.個人情報保護の方法
適 ・ 不適
コメント欄:
(
「不適」とした場合には必ず記載ください。
)
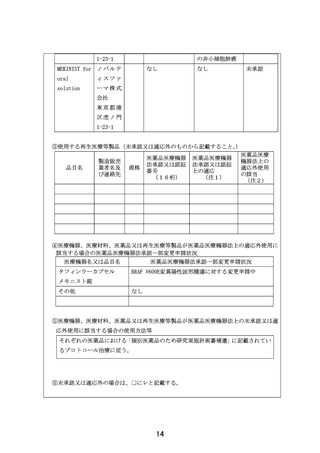
この試験は、AYA がんに対して複数の既存の遺伝子パネル検査結果等に基づいて複数の分子標
的薬を評価するものである。研究実施計画書は、非常に丁寧に書かれている。分子標的薬の
有効性が示されているがん種に対して本邦で成人において薬事承認されているが小児では承
認されていない(小児の用法用量の記載がない)医薬品、あるいは分子標的薬の有効性が示
されているがん種に対して、海外(FDA または EMA)で薬事承認されているが、本邦で小児に
おいて薬事承認されていない医薬品が使用される予定である。これらの医薬品は海外あるい
は成人で先行する臨床試験等において一定の安全性が担保されているとはいえ、本邦あるい
は小児では未承認あるいは適応外であり、その使用については早期臨床開発試験レベルの管
理が必要となる。今回の試験での対象は、0-29 歳までの”AYA がん“の患者であるが、必ず
9