よむ、つかう、まなぶ。
別紙1○「小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子標的治療に関する患者申出療養」の患者申出療養評価会議における事前評価等の取扱いについて (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00026.html |
| 出典情報 | 患者申出療養評価会議(第43回 9/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
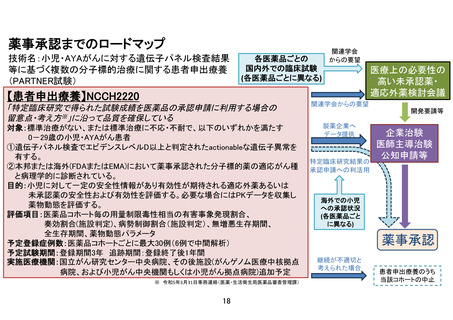
【別添3】「小児・AYA がんに対する遺伝子パネル検査結果等に基づく複数の分
子標的治療に関する患者申出療養」の被験者の適格基準及び選定方法(意見書よ
り抜粋)
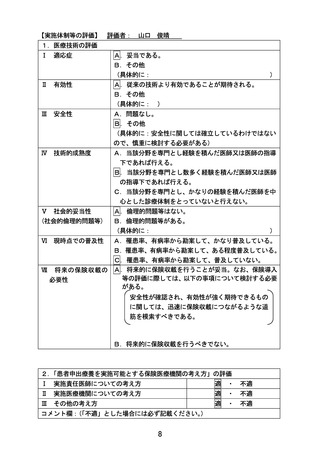
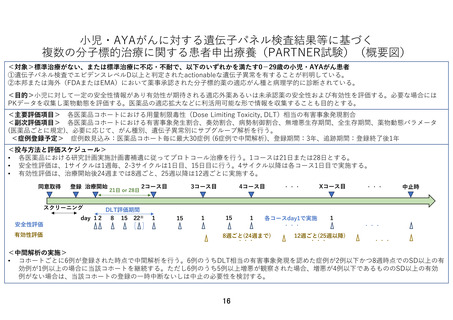
5.患者の適格基準及び選定方法
以下の適格規準をすべて満たす患者を登録適格例とする
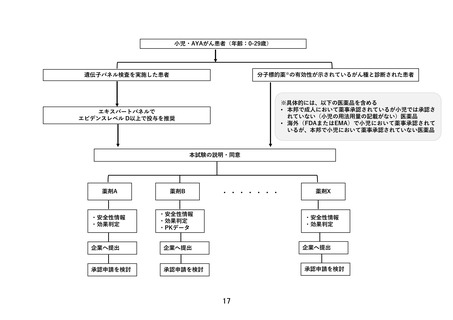
1)組織診によって小児がん国際分類(ICCC-3, International Classification of
Childhood Cancer, third edition)に含まれる腫瘍(I-II を除く)と診断されている
※他施設で病理組織検査が実施されていた場合は、病理標本を取り寄せて、実施医療機関
の病理診断で規準を満たすことが確認されなければならない
2)治癒切除不能(四肢切断など重大な機能損失を伴う切除以外は困難な場合を含む)な
進行性(転移性およびまたは局所進行)の病変を有し、以下の①②いずれかに該当する(前
治療レジメン数は問わない)
①標準治療(もしくは標準治療に準じる治療)が存在しない
②標準治療(もしくは標準治療に準じる治療)が存在する場合には、当該標準治療(もし
くは標準治療に準じる治療)が無効中止または毒性中止された
3)登録時の年齢が 0-29 歳である(ただし各医薬品コホートにおける年齢の除外規準に該
当しないこと)
。
4)治療薬について、当該疾患において患者の年齢またはがん種に対して我が国では薬事
承認が得られていない(治療薬が患者にとって適応外薬あるいは未承認薬となる)
5)以下のいずれかを満たす
①登録前 28 日以内の造影 CT または MRI(頭部・胸部・腹部・骨盤:スライス厚 5 mm 以
下)にて腫瘍性病変を確認できる(測定可能病変の有無を問わない)
②登録前 28 日以内の骨髄検査(骨髄穿刺または骨髄生検)にて腫瘍細胞を認める。
6)以下のいずれかを満たす
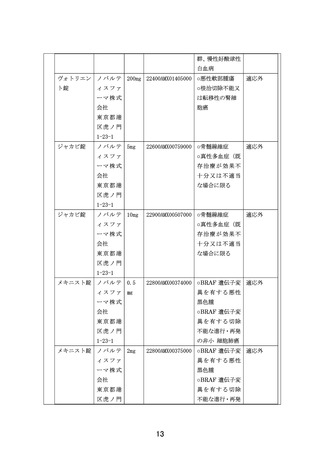
①本邦で保険適用済み、または評価療養として実施されている遺伝子パネル検査を受け、
actionable な遺伝子異常を有することが判明している。かつ、エビデンスレべル D 以上
と判定された actionable な遺伝子異常とそれに基づく治療選択肢を提示したエキスパー
トパネル報告書、およびその根拠となった遺伝子パネル報告書がある。
②本邦または海外(FDA または EMA)において薬事承認された分子標的薬※の適応がん種
と病理学的に診断されている。
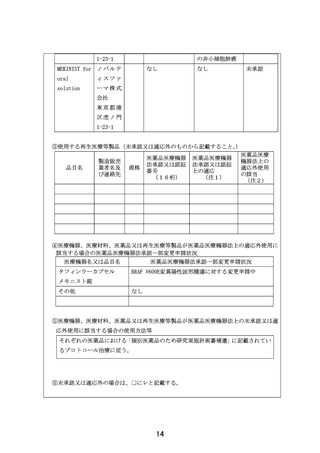
※具体的には、以下の通り
・分子標的薬の有効性が示されているがん種に対して、本邦で成人において薬事承認され
ているが小児では承認されていない(小児の用法用量の記載がない)医薬品
・分子標的薬の有効性が示されているがん種に対して、海外(FDA または EMA)で小児に
おいて薬事承認されているが、本邦で小児において薬事承認されていない医薬品
7)研究責任医師あるいは研究分担医師と患者の相談により、治療薬(患者が申出た医薬
品)を選定したことについて診療録に記録がされている
8)日本国内の医療機関において実施中の企業治験、医師主導治験、先進医療、患者申出
療養の対象ではない。ただし適格規準を満たさない、地理的理由など、これらの臨床試験
21
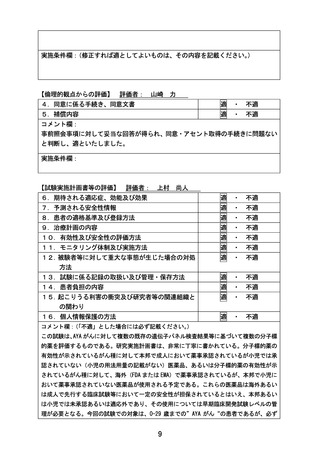
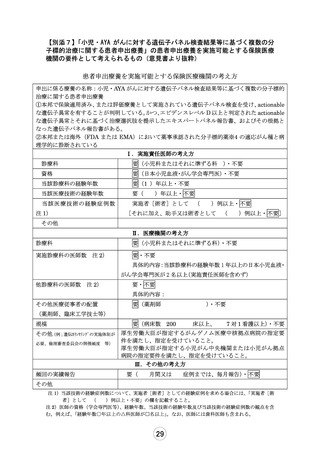
子標的治療に関する患者申出療養」の被験者の適格基準及び選定方法(意見書よ
り抜粋)
5.患者の適格基準及び選定方法
以下の適格規準をすべて満たす患者を登録適格例とする
1)組織診によって小児がん国際分類(ICCC-3, International Classification of
Childhood Cancer, third edition)に含まれる腫瘍(I-II を除く)と診断されている
※他施設で病理組織検査が実施されていた場合は、病理標本を取り寄せて、実施医療機関
の病理診断で規準を満たすことが確認されなければならない
2)治癒切除不能(四肢切断など重大な機能損失を伴う切除以外は困難な場合を含む)な
進行性(転移性およびまたは局所進行)の病変を有し、以下の①②いずれかに該当する(前
治療レジメン数は問わない)
①標準治療(もしくは標準治療に準じる治療)が存在しない
②標準治療(もしくは標準治療に準じる治療)が存在する場合には、当該標準治療(もし
くは標準治療に準じる治療)が無効中止または毒性中止された
3)登録時の年齢が 0-29 歳である(ただし各医薬品コホートにおける年齢の除外規準に該
当しないこと)
。
4)治療薬について、当該疾患において患者の年齢またはがん種に対して我が国では薬事
承認が得られていない(治療薬が患者にとって適応外薬あるいは未承認薬となる)
5)以下のいずれかを満たす
①登録前 28 日以内の造影 CT または MRI(頭部・胸部・腹部・骨盤:スライス厚 5 mm 以
下)にて腫瘍性病変を確認できる(測定可能病変の有無を問わない)
②登録前 28 日以内の骨髄検査(骨髄穿刺または骨髄生検)にて腫瘍細胞を認める。
6)以下のいずれかを満たす
①本邦で保険適用済み、または評価療養として実施されている遺伝子パネル検査を受け、
actionable な遺伝子異常を有することが判明している。かつ、エビデンスレべル D 以上
と判定された actionable な遺伝子異常とそれに基づく治療選択肢を提示したエキスパー
トパネル報告書、およびその根拠となった遺伝子パネル報告書がある。
②本邦または海外(FDA または EMA)において薬事承認された分子標的薬※の適応がん種
と病理学的に診断されている。
※具体的には、以下の通り
・分子標的薬の有効性が示されているがん種に対して、本邦で成人において薬事承認され
ているが小児では承認されていない(小児の用法用量の記載がない)医薬品
・分子標的薬の有効性が示されているがん種に対して、海外(FDA または EMA)で小児に
おいて薬事承認されているが、本邦で小児において薬事承認されていない医薬品
7)研究責任医師あるいは研究分担医師と患者の相談により、治療薬(患者が申出た医薬
品)を選定したことについて診療録に記録がされている
8)日本国内の医療機関において実施中の企業治験、医師主導治験、先進医療、患者申出
療養の対象ではない。ただし適格規準を満たさない、地理的理由など、これらの臨床試験
21