よむ、つかう、まなぶ。
○医薬品の新規薬価収載について 総-5-3 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
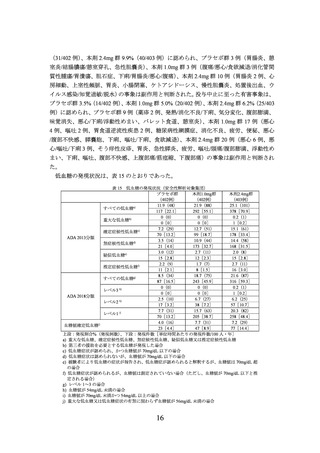
3.臨床成績
製造販売承認時に評価を行った主な臨床試験の成績を示す。
1.
高血圧、脂質異常症又は 2 型糖尿病を有する肥満症患者を対象とした国際共同第
III 相試験(4382 試験)
【試験の概要】
高血圧、脂質異常症又は 2 型糖尿病を有する日本人及び韓国人肥満症患者(目標症例数
400 例(プラセボ群:100 例、本剤 1.7mg 群:100 例、本剤 2.4mg 群:200 例)
)を対象に、
食事療法及び運動療法施行下での本剤の有効性及び安全性を検討するため、プラセボ対照
無作為化二重盲検並行群間比較試験が実施された。
用法・用量は、プラセボ、本剤 1.7mg 又は本剤 2.4mg を週 1 回、大腿部、腹部又は上腕
部に皮下投与(自己注射)された。本剤の開始用量は本剤 1.7mg 群及び本剤 2.4mg 群とも
に 0.25mg とされ、4 週間間隔で 0.5、1.0 及び 1.7mg へ増量し、本剤 2.4mg 群ではさらに 4
週間後に 2.4mg まで増量することとされた。なお、本剤 1.7mg 群及び本剤 2.4mg 群のそれ
ぞれにおいて、本剤 1.7 又は 2.4mg に忍容性のない被験者は、より低用量で投与を継続す
ることが可能とされた。
有効性の主要評価項目は、ベースラインから投与 68 週時までの体重変化率及び投与 68
週時に 5%以上の体重減少を達成した被験者の割合とされた。
(主な選択基準)
18 歳以上(日本人は 20 歳以上)
高血圧、脂質異常症又は 2 型糖尿病1)を有し、かつ BMI が 27.0 kg/m2 以上で高血圧、
脂質異常症若しくは 2 型糖尿病も含めて 2 つ以上の肥満に関連する健康障害2)を有す
る
又は
BMI が 35.0 kg/m2 以上
体重減少のための食事療法を施行しても適切に管理できなかった治療歴を有する
試験期間中、患者には 4 週ごとに来院/電話コンタクトにて以下の食事・運動のカウンセ
リングが行われた。カウンセリングは糖尿病の状態を考慮した上で実施された。食事の内容
と身体活動については患者に毎日、日誌をつけることが推奨された。
1) 2 型糖尿病に関する選択基準は日本人のみに設定され、スクリーニング時の 180 日以上前に 2 型糖尿病と診断され、
HbA1c が 7.0~10.0%の患者とされた。食事療法及び運動療法のみ実施中の患者の他、メトホルミン、SU 薬、SGLT2
阻害薬又はチアゾリジン系薬剤を用いた 3 剤までの併用療法によりスクリーニング時の 90 日以上前から安定した治
療を受けている患者は組入れ可能とされた。
2) BMI が 27.0 kg/m2 以上の患者では、高血圧、脂質異常症又は 2 型糖尿病(日本人のみ)のいずれかを有することに加
えて、本邦の肥満症診療ガイドラインに基づき規定された肥満症に関連する以下の健康障害①~⑪のいずれか 1 つ以
上を有することとされた。①耐糖能障害(2 型糖尿病、耐糖能異常等)、②脂質異常症、③高血圧、④高尿酸血症・痛
風、⑤冠動脈疾患、⑥脳梗塞、⑦非アルコール性脂肪性肝疾患、⑧月経異常・不妊、⑨閉塞性睡眠時無呼吸症候群・
肥満低換気症候群、⑩運動器疾患、⑪肥満関連腎臓病
4
製造販売承認時に評価を行った主な臨床試験の成績を示す。
1.
高血圧、脂質異常症又は 2 型糖尿病を有する肥満症患者を対象とした国際共同第
III 相試験(4382 試験)
【試験の概要】
高血圧、脂質異常症又は 2 型糖尿病を有する日本人及び韓国人肥満症患者(目標症例数
400 例(プラセボ群:100 例、本剤 1.7mg 群:100 例、本剤 2.4mg 群:200 例)
)を対象に、
食事療法及び運動療法施行下での本剤の有効性及び安全性を検討するため、プラセボ対照
無作為化二重盲検並行群間比較試験が実施された。
用法・用量は、プラセボ、本剤 1.7mg 又は本剤 2.4mg を週 1 回、大腿部、腹部又は上腕
部に皮下投与(自己注射)された。本剤の開始用量は本剤 1.7mg 群及び本剤 2.4mg 群とも
に 0.25mg とされ、4 週間間隔で 0.5、1.0 及び 1.7mg へ増量し、本剤 2.4mg 群ではさらに 4
週間後に 2.4mg まで増量することとされた。なお、本剤 1.7mg 群及び本剤 2.4mg 群のそれ
ぞれにおいて、本剤 1.7 又は 2.4mg に忍容性のない被験者は、より低用量で投与を継続す
ることが可能とされた。
有効性の主要評価項目は、ベースラインから投与 68 週時までの体重変化率及び投与 68
週時に 5%以上の体重減少を達成した被験者の割合とされた。
(主な選択基準)
18 歳以上(日本人は 20 歳以上)
高血圧、脂質異常症又は 2 型糖尿病1)を有し、かつ BMI が 27.0 kg/m2 以上で高血圧、
脂質異常症若しくは 2 型糖尿病も含めて 2 つ以上の肥満に関連する健康障害2)を有す
る
又は
BMI が 35.0 kg/m2 以上
体重減少のための食事療法を施行しても適切に管理できなかった治療歴を有する
試験期間中、患者には 4 週ごとに来院/電話コンタクトにて以下の食事・運動のカウンセ
リングが行われた。カウンセリングは糖尿病の状態を考慮した上で実施された。食事の内容
と身体活動については患者に毎日、日誌をつけることが推奨された。
1) 2 型糖尿病に関する選択基準は日本人のみに設定され、スクリーニング時の 180 日以上前に 2 型糖尿病と診断され、
HbA1c が 7.0~10.0%の患者とされた。食事療法及び運動療法のみ実施中の患者の他、メトホルミン、SU 薬、SGLT2
阻害薬又はチアゾリジン系薬剤を用いた 3 剤までの併用療法によりスクリーニング時の 90 日以上前から安定した治
療を受けている患者は組入れ可能とされた。
2) BMI が 27.0 kg/m2 以上の患者では、高血圧、脂質異常症又は 2 型糖尿病(日本人のみ)のいずれかを有することに加
えて、本邦の肥満症診療ガイドラインに基づき規定された肥満症に関連する以下の健康障害①~⑪のいずれか 1 つ以
上を有することとされた。①耐糖能障害(2 型糖尿病、耐糖能異常等)、②脂質異常症、③高血圧、④高尿酸血症・痛
風、⑤冠動脈疾患、⑥脳梗塞、⑦非アルコール性脂肪性肝疾患、⑧月経異常・不妊、⑨閉塞性睡眠時無呼吸症候群・
肥満低換気症候群、⑩運動器疾患、⑪肥満関連腎臓病
4