よむ、つかう、まなぶ。
04 参考資料1-123価肺炎球菌莢膜ポリサッカライドワクチン(肺炎球菌ワクチン)ファクトシート (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36630.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会 ワクチン評価に関する小委員会(第22回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
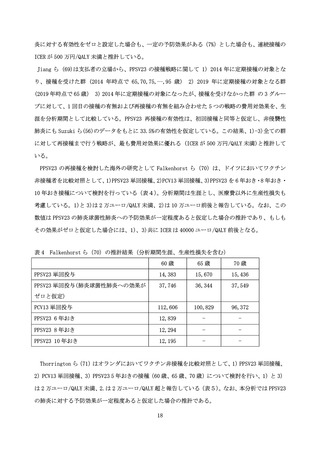
表 3.PPSV23 接種に伴う接種部位及び全身性副反応
再接種グループ(N = 161)
n (%)
113 (70.2)
初回接種グループ(N = 81)
n (%)
41 (50.6)
%の差分
(95% CI)
19.6 (6.6, 32.3)
101 (62.7)
77 (47.8)
18 (11.2)
6 (3.7)
38 (46.9)
34 (42.0)
4 (4.9)
0 (0.0)
15.8 (2.6, 28.7)
接種部位の紅斑 (cm)
何らかの紅斑
0から≦5
5から≦10
>10
57 (35.4)
10 (12.3)
13 (8.1)
10 (6.2)
12 (14.8)
34 (21.1)
2 (2.5)
0 (0.0)
20.6 (9.1, 30.7)
接種部位の腫れ (cm)
何らかの腫れ
0から≦5
5から≦10
>10
62 (38.5)
34 (21.1)
21 (13.0)
7 (4.3)
14 (17.3)
12 (14.8)
2 (2.5)
0 (0.0)
21.2 (9.3, 31.7)
全身性の副反応
発熱 ≧37.5 ℃から<38℃
≧38.0℃から<38.5℃
≧38.5℃
下痢
不快感
鼻咽頭炎
目眩
42 (26.1)
7 (4.3)
3 (1.9)
1 (0.6)
3 (1.9)
4 (2.5)
4 (2.5)
0 (0.0)
16 (19.8)
1 (1.2)
0 (0.0)
0 (0.0)
2 (2.5)
0 (0.0)
1 ()1.2
2 (2.5)
6.3 (-5.4,16.8)
接種部位の何らかの副反応
接種部位の痛み
何らかの痛み
軽度の痛み
中程度の痛み
重篤な痛み
Remschmidt らは 14 の観察研究を検討した PPSV23 の免疫原性と安全性に関する総説を発表してい
る(64)。安全性に関して、著者等は初回接種に比べ再接種では全身、局所の副反応の程度が強かった
としている。また、これらの副反応は通常は軽度で、自然に軽快し、副反応のリスクと程度は接種間
隔が長いほど軽減するとしている。
また、2013 年 4 月から予防接種法に基づいて実施している「予防接種後副反応疑い報告」では、
2013 年 4 月 1 日~2017 年 29 年 12 月 31 日の期間に実施された 14,750,394 接種(医療機関への納入数
量から接種可能のべ人数を推定)に対して、1,246 例(0.008%)の副反応疑い症例が医療機関から報
告された (65)。この内 306 例(0.002%)は医師が重篤として報告しているが、その多くは注射部位
蜂巣炎(114 件)
、発熱(68 件)
、注射部位腫脹(54 件)
、注射部位紅斑(46 件)
、注射部位疼痛(34
件)
、倦怠感(23 件)であった(なお、副反応が重篤か否かについては、統一された基準はなく、医
師の判断に委ねられている)
。
予防接種法に基づいて、PPSV23 接種後に医師に報告が義務づけられている症状・疾患としては、
①アナフィラキシー(接種後 4 時間以内)
、②ギラン・バレ症候群(接種後 28 日以内)
、③血小板減
少性紫斑病(接種後 28 日以内)
、④注射部位壊死又は注射部位潰瘍(接種後 28 日以内)
、⑤蜂巣炎(こ
16
再接種グループ(N = 161)
n (%)
113 (70.2)
初回接種グループ(N = 81)
n (%)
41 (50.6)
%の差分
(95% CI)
19.6 (6.6, 32.3)
101 (62.7)
77 (47.8)
18 (11.2)
6 (3.7)
38 (46.9)
34 (42.0)
4 (4.9)
0 (0.0)
15.8 (2.6, 28.7)
接種部位の紅斑 (cm)
何らかの紅斑
0から≦5
5から≦10
>10
57 (35.4)
10 (12.3)
13 (8.1)
10 (6.2)
12 (14.8)
34 (21.1)
2 (2.5)
0 (0.0)
20.6 (9.1, 30.7)
接種部位の腫れ (cm)
何らかの腫れ
0から≦5
5から≦10
>10
62 (38.5)
34 (21.1)
21 (13.0)
7 (4.3)
14 (17.3)
12 (14.8)
2 (2.5)
0 (0.0)
21.2 (9.3, 31.7)
全身性の副反応
発熱 ≧37.5 ℃から<38℃
≧38.0℃から<38.5℃
≧38.5℃
下痢
不快感
鼻咽頭炎
目眩
42 (26.1)
7 (4.3)
3 (1.9)
1 (0.6)
3 (1.9)
4 (2.5)
4 (2.5)
0 (0.0)
16 (19.8)
1 (1.2)
0 (0.0)
0 (0.0)
2 (2.5)
0 (0.0)
1 ()1.2
2 (2.5)
6.3 (-5.4,16.8)
接種部位の何らかの副反応
接種部位の痛み
何らかの痛み
軽度の痛み
中程度の痛み
重篤な痛み
Remschmidt らは 14 の観察研究を検討した PPSV23 の免疫原性と安全性に関する総説を発表してい
る(64)。安全性に関して、著者等は初回接種に比べ再接種では全身、局所の副反応の程度が強かった
としている。また、これらの副反応は通常は軽度で、自然に軽快し、副反応のリスクと程度は接種間
隔が長いほど軽減するとしている。
また、2013 年 4 月から予防接種法に基づいて実施している「予防接種後副反応疑い報告」では、
2013 年 4 月 1 日~2017 年 29 年 12 月 31 日の期間に実施された 14,750,394 接種(医療機関への納入数
量から接種可能のべ人数を推定)に対して、1,246 例(0.008%)の副反応疑い症例が医療機関から報
告された (65)。この内 306 例(0.002%)は医師が重篤として報告しているが、その多くは注射部位
蜂巣炎(114 件)
、発熱(68 件)
、注射部位腫脹(54 件)
、注射部位紅斑(46 件)
、注射部位疼痛(34
件)
、倦怠感(23 件)であった(なお、副反応が重篤か否かについては、統一された基準はなく、医
師の判断に委ねられている)
。
予防接種法に基づいて、PPSV23 接種後に医師に報告が義務づけられている症状・疾患としては、
①アナフィラキシー(接種後 4 時間以内)
、②ギラン・バレ症候群(接種後 28 日以内)
、③血小板減
少性紫斑病(接種後 28 日以内)
、④注射部位壊死又は注射部位潰瘍(接種後 28 日以内)
、⑤蜂巣炎(こ
16