よむ、つかう、まなぶ。
資料5-1~2 モメタゾンフランカルボン酸エステル水和物 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198111_00024.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第26回 12/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.スイッチ OTC 化の妥当性評価にあたっての必要情報
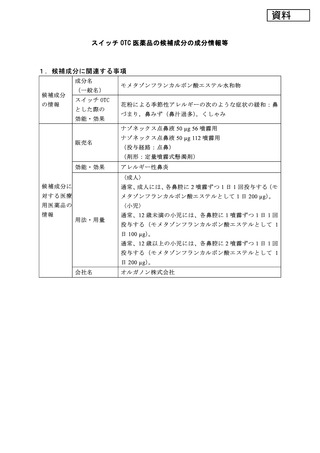
承認年月日
再審査期間
再審査結果
通知日
2008 年 7 月 16 日(成人:56 噴霧用、112 噴霧用)
2012 年 5 月 25 日(小児用法・用量の追加)
2008 年 7 月 16 日~2016 年 7 月 15 日(成人)
2012 年 5 月 25 日~2016 年 7 月 15 日(小児)
2018 年 3 月 29 日(成人・小児)
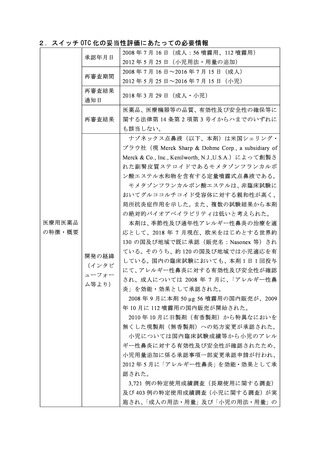
医薬品、医療機器等の品質、有効性及び安全性の確保等に
再審査結果
関する法律第 14 条第 2 項第 3 号イからハまでのいずれに
も該当しない。
ナゾネックス点鼻液(以下、本剤)は米国シェリング・
プラウ社(現 Merck Sharp & Dohme Corp., a subsidiary of
Merck & Co., Inc., Kenilworth, N.J.,U.S.A.)によって創製さ
れた副腎皮質ステロイ ドであるモメタゾンフ ランカルボ
ン酸エステル水和物を含有する定量噴霧式点鼻液である。
モメタゾンフランカルボン酸エステルは、非臨床試験に
おいてグルココルチコイド受容体に対する親和性が高く、
局所抗炎症作用を示した。また、複数の試験結果から本剤
の絶対的バイオアベイラビリティは低いと考えられた。
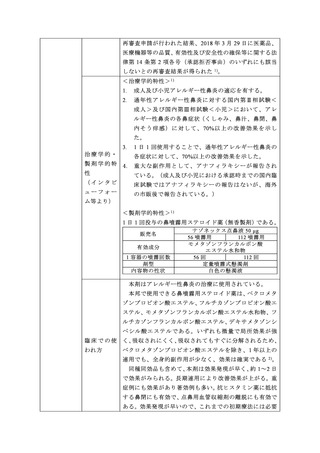
医療用医薬品
本剤は、季節性及び通年性アレルギー性鼻炎の治療を適
の特徴・概要
応として、2018 年 7 月現在、欧米をはじめとする世界約
130 の国及び地域で既に承認(販売名:Nasonex 等)され
開発の経緯
(インタビ
ューフォー
ム等より)
ている。そのうち、約 120 の国及び地域では小児適応を有
している。国内の臨床試験においても、本剤 1 日 1 回投与
にて、アレルギー性鼻炎に対する有効性及び安全性が確認
され、成人については 2008 年 7 月に、「アレルギー性鼻
炎」を効能・効果として承認された。
2008 年 9 月に本剤 50 µg 56 噴霧用の国内販売が、2009
年 10 月に 112 噴霧用の国内販売が開始された。
2010 年 10 月に旧製剤(有香製剤)から特異なにおいを
無くした現製剤(無香製剤)への処方変更が承認された。
小児については国 内臨 床試験成績等から 小児 のアレル
ギー性鼻炎に対する有効性及び安全性が確認されたため、
小児用量追加に係る承認事項一部変更承認申請が行われ、
2012 年 5 月に「アレルギー性鼻炎」を効能・効果として承
認された。
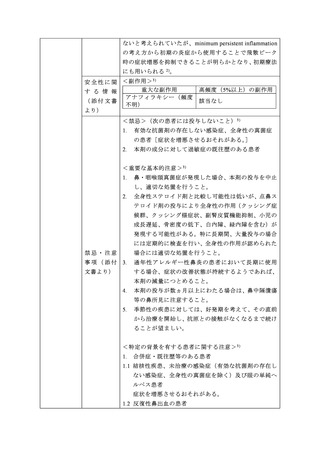
3,721 例の特定使用成績調査(長期使用に関する調査)
及び 403 例の特定使用成績調査(小児に関する調査)が実
施され、
「成人の用法・用量」及び「小児の用法・用量」の
48 / 71
承認年月日
再審査期間
再審査結果
通知日
2008 年 7 月 16 日(成人:56 噴霧用、112 噴霧用)
2012 年 5 月 25 日(小児用法・用量の追加)
2008 年 7 月 16 日~2016 年 7 月 15 日(成人)
2012 年 5 月 25 日~2016 年 7 月 15 日(小児)
2018 年 3 月 29 日(成人・小児)
医薬品、医療機器等の品質、有効性及び安全性の確保等に
再審査結果
関する法律第 14 条第 2 項第 3 号イからハまでのいずれに
も該当しない。
ナゾネックス点鼻液(以下、本剤)は米国シェリング・
プラウ社(現 Merck Sharp & Dohme Corp., a subsidiary of
Merck & Co., Inc., Kenilworth, N.J.,U.S.A.)によって創製さ
れた副腎皮質ステロイ ドであるモメタゾンフ ランカルボ
ン酸エステル水和物を含有する定量噴霧式点鼻液である。
モメタゾンフランカルボン酸エステルは、非臨床試験に
おいてグルココルチコイド受容体に対する親和性が高く、
局所抗炎症作用を示した。また、複数の試験結果から本剤
の絶対的バイオアベイラビリティは低いと考えられた。
医療用医薬品
本剤は、季節性及び通年性アレルギー性鼻炎の治療を適
の特徴・概要
応として、2018 年 7 月現在、欧米をはじめとする世界約
130 の国及び地域で既に承認(販売名:Nasonex 等)され
開発の経緯
(インタビ
ューフォー
ム等より)
ている。そのうち、約 120 の国及び地域では小児適応を有
している。国内の臨床試験においても、本剤 1 日 1 回投与
にて、アレルギー性鼻炎に対する有効性及び安全性が確認
され、成人については 2008 年 7 月に、「アレルギー性鼻
炎」を効能・効果として承認された。
2008 年 9 月に本剤 50 µg 56 噴霧用の国内販売が、2009
年 10 月に 112 噴霧用の国内販売が開始された。
2010 年 10 月に旧製剤(有香製剤)から特異なにおいを
無くした現製剤(無香製剤)への処方変更が承認された。
小児については国 内臨 床試験成績等から 小児 のアレル
ギー性鼻炎に対する有効性及び安全性が確認されたため、
小児用量追加に係る承認事項一部変更承認申請が行われ、
2012 年 5 月に「アレルギー性鼻炎」を効能・効果として承
認された。
3,721 例の特定使用成績調査(長期使用に関する調査)
及び 403 例の特定使用成績調査(小児に関する調査)が実
施され、
「成人の用法・用量」及び「小児の用法・用量」の
48 / 71