よむ、つかう、まなぶ。
中間とりまとめを踏まえた政策目標と工程表 (32 ページ)
出典
| 公開元URL | https://www.cas.go.jp/jp/seisaku/souyakuryoku/pdf/chuukantorimatome_mokuhyou.pdf |
| 出典情報 | 「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議」中間とりまとめを踏まえた政策目標と工程表(7/30)《内閣官房》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
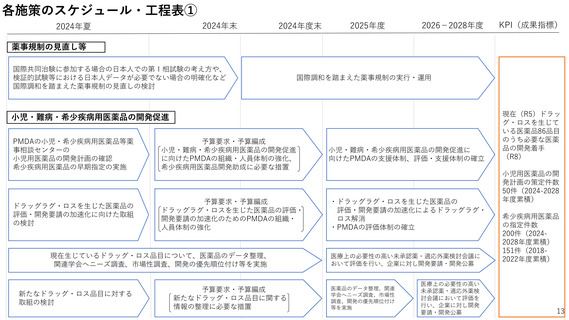
2ー1.薬事規制の見直し
<施策の目的>
成果指標・KPI
国民に最新の医薬品を迅速に届けるため、ドラッグ・ラグ/ドラッグ・ロスの
解消が喫緊の課題。
特に、国際的な同時開発の流れに日本が組み込まれるためには、国際調和を踏
まえた薬事規制の見直しが必要。
「創薬力の強化・安定供給の確保等のための薬事規制の
あり方に関する検討会」(令和6年4月報告書とりまと
め)で示された方針に基づき、薬事規制の見直しを進め
創 薬 力 の 強 化 ・ 安 定 供 給 の 確 保 等 の た め の 薬 事 規 制 の あり 方 に 関 す る検 討 会
• 昨年から開始された「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」においては、医薬
品の早期上市や安定供給を図る観点から、幅広い観点で議論がなされ、令和5年6月9日にとりまとめられてお
り、薬事規制のあり方等関係についても課題が指摘されている。
• 具体的には、いわゆるドラッグロス問題の解消や、安定供給の確保、小児医薬品開発の促進等を図るため、薬事
規制のあり方を検討する必要がある。
• このため、本検討会を立ち上げ、これらの論点について議論を行い、令和6年4月24日に報告書をとりまとめた。
る。
具体的には、日本の施設が国際共同治験に参加する場合
の日本人での第Ⅰ相試験の考え方や、検証的試験等にお
ける日本人データが必要でない場合の明確化などを実施
した上で、その着実な運用を進める。
<目標>
左記品目のうち必要
な医薬品について開
発着手(R8まで)
参考資料
<施策の内容>
国際調和を踏まえた薬事規制の見直し
<現状>
ドラッグロスを生
じている医薬品:
86品目(R5)
スケジュール
検討事項
開発促進
臨床試験
市販後
安全対策
希少疾病用医薬品の指定のあり方について
小児用医薬品の開発促進に資する薬事審査等のあり方について
我が国の承認審査における日本人データの必要性の整理について
治験の更なる効率化(エコシステム)について
製造販売後に実施する使用成績調査等のあり方について
リアルワールドデータの活用のあり方について
品質
医薬品の製造方法等に係る薬事審査等のあり方について
情報発信
我が国の薬事制度に関する海外への情報発信について
令和5年7月10日
希少疾病用医薬品、小児用医薬品
8月7日
日本人第Ⅰ相試験
9月13日
日本人第Ⅰ相試験
10月13日
製造方法等
11月15日
GMP、海外情報発信
12月13日
日本人データ、迅速承認
令和6年1月12日
使用成績調査、RWD
2月8日
日本人データ、迅速承認
3月21日
使用成績調査・RWD、治験エコシステム、
PMDAの体制等
4月24日
報告書とりまとめ
1
32
<施策の目的>
成果指標・KPI
国民に最新の医薬品を迅速に届けるため、ドラッグ・ラグ/ドラッグ・ロスの
解消が喫緊の課題。
特に、国際的な同時開発の流れに日本が組み込まれるためには、国際調和を踏
まえた薬事規制の見直しが必要。
「創薬力の強化・安定供給の確保等のための薬事規制の
あり方に関する検討会」(令和6年4月報告書とりまと
め)で示された方針に基づき、薬事規制の見直しを進め
創 薬 力 の 強 化 ・ 安 定 供 給 の 確 保 等 の た め の 薬 事 規 制 の あり 方 に 関 す る検 討 会
• 昨年から開始された「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」においては、医薬
品の早期上市や安定供給を図る観点から、幅広い観点で議論がなされ、令和5年6月9日にとりまとめられてお
り、薬事規制のあり方等関係についても課題が指摘されている。
• 具体的には、いわゆるドラッグロス問題の解消や、安定供給の確保、小児医薬品開発の促進等を図るため、薬事
規制のあり方を検討する必要がある。
• このため、本検討会を立ち上げ、これらの論点について議論を行い、令和6年4月24日に報告書をとりまとめた。
る。
具体的には、日本の施設が国際共同治験に参加する場合
の日本人での第Ⅰ相試験の考え方や、検証的試験等にお
ける日本人データが必要でない場合の明確化などを実施
した上で、その着実な運用を進める。
<目標>
左記品目のうち必要
な医薬品について開
発着手(R8まで)
参考資料
<施策の内容>
国際調和を踏まえた薬事規制の見直し
<現状>
ドラッグロスを生
じている医薬品:
86品目(R5)
スケジュール
検討事項
開発促進
臨床試験
市販後
安全対策
希少疾病用医薬品の指定のあり方について
小児用医薬品の開発促進に資する薬事審査等のあり方について
我が国の承認審査における日本人データの必要性の整理について
治験の更なる効率化(エコシステム)について
製造販売後に実施する使用成績調査等のあり方について
リアルワールドデータの活用のあり方について
品質
医薬品の製造方法等に係る薬事審査等のあり方について
情報発信
我が国の薬事制度に関する海外への情報発信について
令和5年7月10日
希少疾病用医薬品、小児用医薬品
8月7日
日本人第Ⅰ相試験
9月13日
日本人第Ⅰ相試験
10月13日
製造方法等
11月15日
GMP、海外情報発信
12月13日
日本人データ、迅速承認
令和6年1月12日
使用成績調査、RWD
2月8日
日本人データ、迅速承認
3月21日
使用成績調査・RWD、治験エコシステム、
PMDAの体制等
4月24日
報告書とりまとめ
1
32