よむ、つかう、まなぶ。
中間とりまとめを踏まえた政策目標と工程表 (5 ページ)
出典
| 公開元URL | https://www.cas.go.jp/jp/seisaku/souyakuryoku/pdf/chuukantorimatome_mokuhyou.pdf |
| 出典情報 | 「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議」中間とりまとめを踏まえた政策目標と工程表(7/30)《内閣官房》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
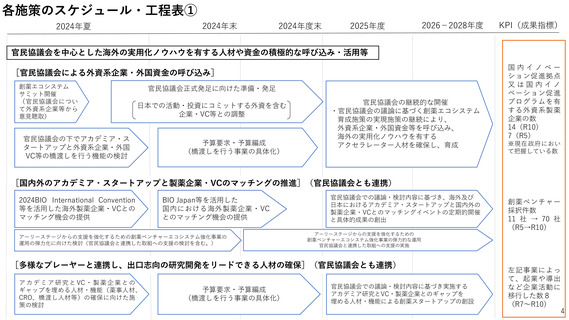
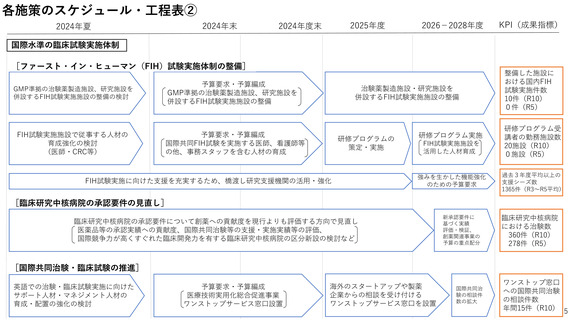
各施策のスケジュール・工程表②
2024年夏
2024年末
2025年度
2024年度末
2026-2028年度
KPI(成果指標)
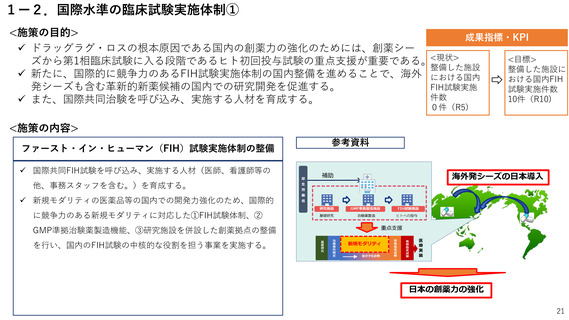
国際水準の臨床試験実施体制
[ファースト・イン・ヒューマン(FIH)試験実施体制の整備]
GMP準拠の治験薬製造施設、研究施設を
併設するFIH試験実施施設の整備の検討
予算要求・予算編成
GMP準拠の治験薬製造施設、研究施設を
併設するFIH試験実施施設の整備
FIH試験実施施設で従事する人材の
育成強化の検討
(医師・CRC等)
予算要求・予算編成
国際共同FIH試験を実施する医師、看護師等
の他、事務スタッフを含む人材の育成
治験薬製造施設・研究施設を
併設するFIH試験実施施設の整備
研修プログラムの
策定・実施
FIH試験実施に向けた支援を充実するため、橋渡し研究支援機関の活用・強化
研修プログラム実施
FIH試験実施施設を
活用した人材育成
強みを生かした機能強化
のための予算要求
整備した施設に
おける国内FIH
試験実施件数
10件(R10)
0件(R5)
研修プログラム受
講者の勤務施設数
20施設(R10)
0施設(R5)
過去3年度平均以上の
支援シーズ数
1365件(R3~R5平均)
[臨床研究中核病院の承認要件の見直し]
臨床研究中核病院の承認要件について創薬への貢献度を現行よりも評価する方向で見直し
医薬品等の承認実績への貢献度、国際共同治験等の支援・実施実績等の評価、
国際競争力が高くすぐれた臨床開発力を有する臨床研究中核病院の区分新設の検討など
新承認要件に
基づく実績
評価・検証、
創薬関連事業の
予算の重点配分
臨床研究中核病院
における治験数
360件(R10)
278件(R5)
[国際共同治験・臨床試験の推進]
英語での治験・臨床試験実施に向けた
サポート人材・マネジメント人材の
育成・配置の強化の検討
予算要求・予算編成
医療技術実用化総合促進事業
ワンストップサービス窓口設置
海外のスタートアップや製薬
企業からの相談を受け付ける
ワンストップサービス窓口を設置
国際共同治
験の相談件
数の拡大
ワンストップ窓口
への国際共同治験
の相談件数
年間15件(R10)
5 5
2024年夏
2024年末
2025年度
2024年度末
2026-2028年度
KPI(成果指標)
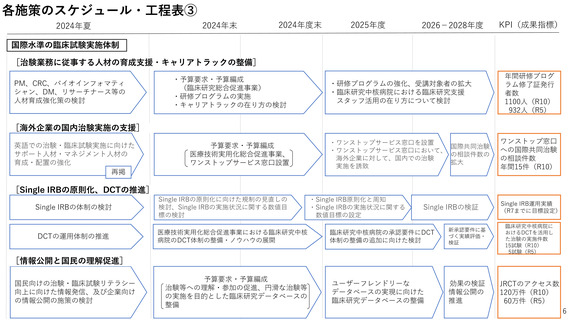
国際水準の臨床試験実施体制
[ファースト・イン・ヒューマン(FIH)試験実施体制の整備]
GMP準拠の治験薬製造施設、研究施設を
併設するFIH試験実施施設の整備の検討
予算要求・予算編成
GMP準拠の治験薬製造施設、研究施設を
併設するFIH試験実施施設の整備
FIH試験実施施設で従事する人材の
育成強化の検討
(医師・CRC等)
予算要求・予算編成
国際共同FIH試験を実施する医師、看護師等
の他、事務スタッフを含む人材の育成
治験薬製造施設・研究施設を
併設するFIH試験実施施設の整備
研修プログラムの
策定・実施
FIH試験実施に向けた支援を充実するため、橋渡し研究支援機関の活用・強化
研修プログラム実施
FIH試験実施施設を
活用した人材育成
強みを生かした機能強化
のための予算要求
整備した施設に
おける国内FIH
試験実施件数
10件(R10)
0件(R5)
研修プログラム受
講者の勤務施設数
20施設(R10)
0施設(R5)
過去3年度平均以上の
支援シーズ数
1365件(R3~R5平均)
[臨床研究中核病院の承認要件の見直し]
臨床研究中核病院の承認要件について創薬への貢献度を現行よりも評価する方向で見直し
医薬品等の承認実績への貢献度、国際共同治験等の支援・実施実績等の評価、
国際競争力が高くすぐれた臨床開発力を有する臨床研究中核病院の区分新設の検討など
新承認要件に
基づく実績
評価・検証、
創薬関連事業の
予算の重点配分
臨床研究中核病院
における治験数
360件(R10)
278件(R5)
[国際共同治験・臨床試験の推進]
英語での治験・臨床試験実施に向けた
サポート人材・マネジメント人材の
育成・配置の強化の検討
予算要求・予算編成
医療技術実用化総合促進事業
ワンストップサービス窓口設置
海外のスタートアップや製薬
企業からの相談を受け付ける
ワンストップサービス窓口を設置
国際共同治
験の相談件
数の拡大
ワンストップ窓口
への国際共同治験
の相談件数
年間15件(R10)
5 5