よむ、つかう、まなぶ。
参考資料3:「創薬力の向上により国民に最新の医薬品を迅速に届けるための構想会議」中間とりまとめを踏まえた政策目標と工程表 (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
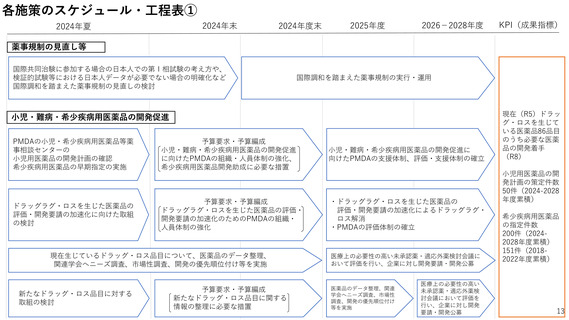
2ー3.PMDAの相談・審査体制
<施策の目的>
成果指標・KPI
我が国の創薬力強化のため、医薬品を開発するスタートアップ等に対し、早い
段階から薬事規制面での相談・支援の強化が必要。
海外発の革新的医薬品の国内導入を推進するため、海外のスタートアップ等に
対する積極的な相談支援等を行う仕組みが必要。
<施策の内容>
<現状>
ドラッグロスを生
じている医薬品:
86品目(R5)
<目標>
左記品目のうち必要
な医薬品について開
発着手(R8まで)
新規モダリティの実用化推進のための相談・支援
海外発信の強化、各種英語対応や国際共同審査枠組みへの参
加等
PMDAが、新規モダリティ等に対する各種規制要件や留
PMDAのワシントンDC事務所を令和6年度に設置し、こ
意事項を早期の段階で示すとともに、スタートアップ等
れを拠点として、日本の薬事規制の取組について海外の
に対し開発の早期段階から相談・支援を行う。
スタートアップ等に対する情報発信や相談対応を強化。
そのために必要なPMDAの組織・人員体制の強化を図る。
各種英語対応の推進や、国際的な審査協同の枠組みへの
積極的参加などの国際化を推進。
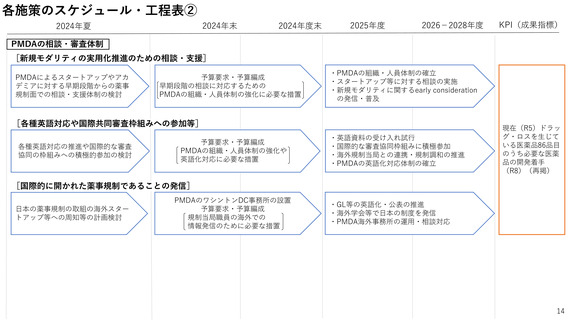
<新組織>
①新規モダリティの規制要件等の早期提示
②開発計画に対する相談・支援(一部無償・英語)
支援強化
スタートアップ等
現地(商談会、学会等)にて
日本の薬事制度の発信
日本での開発について無料相談
米国事務所
米国ベンチャー企業
34
<施策の目的>
成果指標・KPI
我が国の創薬力強化のため、医薬品を開発するスタートアップ等に対し、早い
段階から薬事規制面での相談・支援の強化が必要。
海外発の革新的医薬品の国内導入を推進するため、海外のスタートアップ等に
対する積極的な相談支援等を行う仕組みが必要。
<施策の内容>
<現状>
ドラッグロスを生
じている医薬品:
86品目(R5)
<目標>
左記品目のうち必要
な医薬品について開
発着手(R8まで)
新規モダリティの実用化推進のための相談・支援
海外発信の強化、各種英語対応や国際共同審査枠組みへの参
加等
PMDAが、新規モダリティ等に対する各種規制要件や留
PMDAのワシントンDC事務所を令和6年度に設置し、こ
意事項を早期の段階で示すとともに、スタートアップ等
れを拠点として、日本の薬事規制の取組について海外の
に対し開発の早期段階から相談・支援を行う。
スタートアップ等に対する情報発信や相談対応を強化。
そのために必要なPMDAの組織・人員体制の強化を図る。
各種英語対応の推進や、国際的な審査協同の枠組みへの
積極的参加などの国際化を推進。
<新組織>
①新規モダリティの規制要件等の早期提示
②開発計画に対する相談・支援(一部無償・英語)
支援強化
スタートアップ等
現地(商談会、学会等)にて
日本の薬事制度の発信
日本での開発について無料相談
米国事務所
米国ベンチャー企業
34