よむ、つかう、まなぶ。
薬-1 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43714.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第227回 9/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
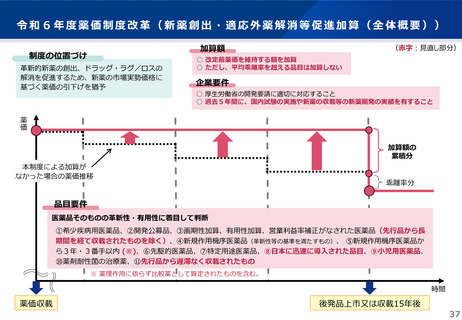
令和6年薬価制度改革
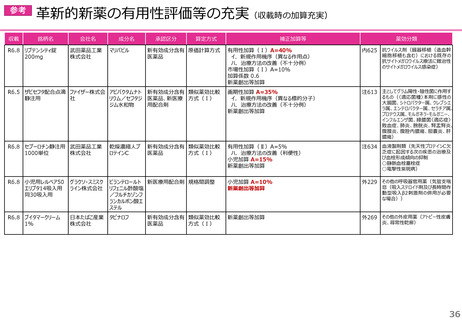
新薬収載時の補正加算
画期性加算(70~120%)
市場性加算(Ⅰ)(10~20%)
次の要件を全て満たす新規収載品
希少疾病用医薬品であって、対象となる疾病等に係る効能効果が、主たる効能
イ 臨床上有用な新規の作用機序を有すること。
効果であるもの
ロ 類似薬又は既存治療に比して、高い有効性又は安全性を有することが、客観
的に示されていること
ハ 当該新規収載品により、当該新規収載品の対象となる疾病又は負傷の治療方
市場性加算(Ⅱ)(5%)
主たる効能効果が、市場規模が小さいものとして別に定める薬効に該当するもの
法の改善が客観的に示されていること
有用性加算(Ⅰ)(35~60%)
併
算
定
不
可
特定用途加算(5~20%)
特定用途医薬品として指定されたもの
画期性加算の3要件のうち2つの要件を満たす新規収載品
小児加算(5~20%)
有用性加算(Ⅱ)(5~30%)
次のいずれかの要件を満たす新規収載品 ※イ~ハは画期性加算の要件と同じ
イ 臨床上有用な新規の作用機序を有すること
ロ 類似薬又は既存治療に比して、高い有効性又は安全性を有することが、客観的に
示されていること
ハ 当該新規収載品により、当該新規収載品の対象となる疾病又は負傷の治療方法
の改善が客観的に示されていること
ニ 製剤における工夫により、類似薬又は既存治療に比して、高い医療上の有用
性を有することが、客観的に示されていること
満たした要件の数によって判断
※ 複数の補正加算に該当する場合には、それぞれの加算の割合の和を算定
に用いる。(再生医療等製品については、市場規模等により加算の割合
を補正)
主たる効能効果又は当該効能効果に係る用法用量に、小児に係るも
のが明示的に含まれているもの
先駆加算(10~20%)
先駆的医薬品として指定されたもの(旧制度での指定品目を含む)
<世界に先駆けて日本で開発されたもの>
迅速導入加算(5~10%)
【新設】
併
算
定
不
可
上記に準じて、日本へ迅速に導入されたもの(以下の要件を満たすもの)
・ 国際的な開発が進行しているもの(国際共同治験の実施等)
・ 優先審査品目
・ 申請・承認が欧米より早い又は欧米で最も早い申請・承認から6か月以内の品目
※ 比較薬が加算を受けている場合は加算対象外(一部例外を除く。)
6
新薬収載時の補正加算
画期性加算(70~120%)
市場性加算(Ⅰ)(10~20%)
次の要件を全て満たす新規収載品
希少疾病用医薬品であって、対象となる疾病等に係る効能効果が、主たる効能
イ 臨床上有用な新規の作用機序を有すること。
効果であるもの
ロ 類似薬又は既存治療に比して、高い有効性又は安全性を有することが、客観
的に示されていること
ハ 当該新規収載品により、当該新規収載品の対象となる疾病又は負傷の治療方
市場性加算(Ⅱ)(5%)
主たる効能効果が、市場規模が小さいものとして別に定める薬効に該当するもの
法の改善が客観的に示されていること
有用性加算(Ⅰ)(35~60%)
併
算
定
不
可
特定用途加算(5~20%)
特定用途医薬品として指定されたもの
画期性加算の3要件のうち2つの要件を満たす新規収載品
小児加算(5~20%)
有用性加算(Ⅱ)(5~30%)
次のいずれかの要件を満たす新規収載品 ※イ~ハは画期性加算の要件と同じ
イ 臨床上有用な新規の作用機序を有すること
ロ 類似薬又は既存治療に比して、高い有効性又は安全性を有することが、客観的に
示されていること
ハ 当該新規収載品により、当該新規収載品の対象となる疾病又は負傷の治療方法
の改善が客観的に示されていること
ニ 製剤における工夫により、類似薬又は既存治療に比して、高い医療上の有用
性を有することが、客観的に示されていること
満たした要件の数によって判断
※ 複数の補正加算に該当する場合には、それぞれの加算の割合の和を算定
に用いる。(再生医療等製品については、市場規模等により加算の割合
を補正)
主たる効能効果又は当該効能効果に係る用法用量に、小児に係るも
のが明示的に含まれているもの
先駆加算(10~20%)
先駆的医薬品として指定されたもの(旧制度での指定品目を含む)
<世界に先駆けて日本で開発されたもの>
迅速導入加算(5~10%)
【新設】
併
算
定
不
可
上記に準じて、日本へ迅速に導入されたもの(以下の要件を満たすもの)
・ 国際的な開発が進行しているもの(国際共同治験の実施等)
・ 優先審査品目
・ 申請・承認が欧米より早い又は欧米で最も早い申請・承認から6か月以内の品目
※ 比較薬が加算を受けている場合は加算対象外(一部例外を除く。)
6