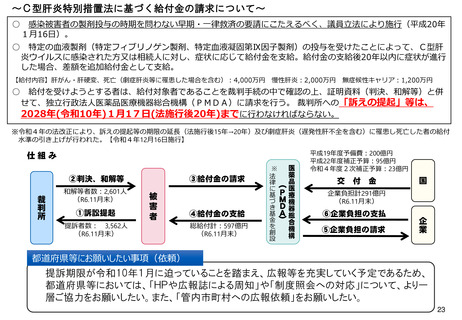
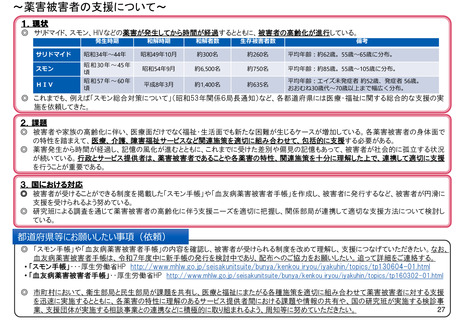
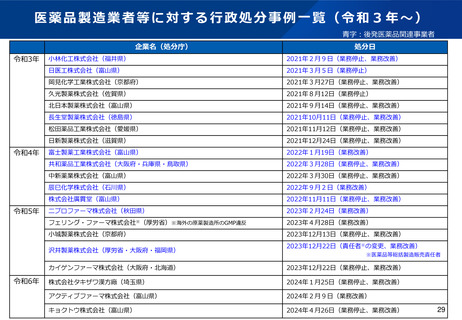
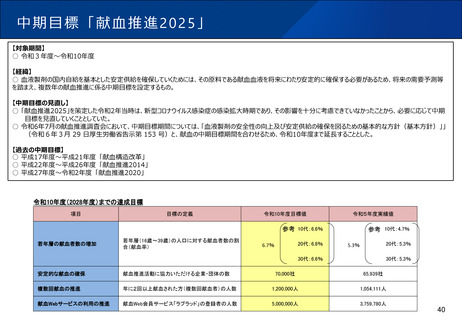
よむ、つかう、まなぶ。
令和6年度 全国厚生労働関係部局長会議(医薬局) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/content/10200000/001391540.pdf |
| 出典情報 | 令和6年度 全国厚生労働関係部局長会議 医薬局(2/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
厚生科学審議会医薬品医療機器制度部会とりまとめ
概要①
背景等
令和元年改正医薬品医療機器等法の検討規定に基づき、改正法の施行状況を踏まえた更なる制度改善に加え、人口構造の変化や技術革新等によ
り新たに求められる対応を実現する観点から、令和6年4月以降、関係業界へのヒアリングを含め計 10回にわたり検討を行い、令和7年1月10日にと
りまとめを公表。
具体的な方策
①医薬品等の品質確保及び安全対策の強化、②品質の確保された医療用医薬品等の供給、③ドラッグ・ラグやドラッグ・ロス解消に向けた創薬環
境・規制環境の整備、④薬局機能・薬剤師業務のあり方の見直し及び医薬品の適正使用の推進について、それぞれ次のような見直しを行うことが必要。
①医薬品等の品質確保及び安全対策の強化 ※法改正事項以外のものを除く。以下同じ。
1.製造販売業者等による品質保証責任の明確化等
4. 国家検定制度の合理化
○ 医薬品等の製造販売業者等に対し、責任役員が原因で薬事に関する法令 ○ 実地試験によらずに、書面審査のみによる検査に合格した場合であっても医
薬品等の販売等を可能とする。
違反が生じた場合等、保健衛生上の危害の発生又は拡大を防止するために
特に必要な場合には、当該責任役員の変更を命じることができるようにする。 5. 感染症定期報告制度の見直し
○ 医薬品製造販売業者に対し、製造所における製造管理及び品質管理の定 ○ 定期的な報告ではなく、再生医療等製品又は生物由来製品のリスク
が高い場合に速やかに評価・検討結果の報告を求めるとともに、報告対
期的な確認及び情報の収集や、品質保証責任者の設置を義務付ける。
象がない場合は報告を不要とする。
○ 医薬品製造業者に対し、承認申請時に限らず製造管理・品質管理上の基
6. 体外診断用医薬品の特性を踏まえた性能評価
準の遵守を義務付ける。
等
○ 体外診断用医薬品の市販後の性能担保のため、製造販売業者に対し、
2.医薬品安全管理責任者の設置その他の製造販売後安全管理
情報収集、評価、報告を義務付けるとともに、市販後の性能が担保されない
○ 医薬品製造販売業者に対し、医薬品リスク管理計画の作成及び当該
場合には承認を取り消す仕組みを導入する。
計画に基づくリスク管理の実施や、安全管理責任者の設置を義務付ける。 7. 医薬品製造管理者等の要件の見直し
○ リアルワールドデータのみによる再審査又は使用成績評価の申請が可能 ○ 医薬品及び体外診断用医薬品の製造管理者について、薬剤師を置くこと
であることを明確化する。
等
が著しく困難であると認められる場合は薬剤師以外の技術者をもって代えるこ
3.GMP適合性調査の見直し
とができる特例を設ける。
○ 製造所のリスク評価を行い、低リスクと評価された場合は調査不要とし、製造 8. 登録認証制度の安定的な運用に向けた制度の見直し
管理・品質管理上のリスクの高い製造所に対しては高頻度で実地調査を行え ○ 登録認証機関が製造販売業者に対して行う実地調査にPMDAが立ち会っ
るようにする。
等
て助言を行えるようにするとともに、業務の休廃止に関する規定を整備する。
4
概要①
背景等
令和元年改正医薬品医療機器等法の検討規定に基づき、改正法の施行状況を踏まえた更なる制度改善に加え、人口構造の変化や技術革新等によ
り新たに求められる対応を実現する観点から、令和6年4月以降、関係業界へのヒアリングを含め計 10回にわたり検討を行い、令和7年1月10日にと
りまとめを公表。
具体的な方策
①医薬品等の品質確保及び安全対策の強化、②品質の確保された医療用医薬品等の供給、③ドラッグ・ラグやドラッグ・ロス解消に向けた創薬環
境・規制環境の整備、④薬局機能・薬剤師業務のあり方の見直し及び医薬品の適正使用の推進について、それぞれ次のような見直しを行うことが必要。
①医薬品等の品質確保及び安全対策の強化 ※法改正事項以外のものを除く。以下同じ。
1.製造販売業者等による品質保証責任の明確化等
4. 国家検定制度の合理化
○ 医薬品等の製造販売業者等に対し、責任役員が原因で薬事に関する法令 ○ 実地試験によらずに、書面審査のみによる検査に合格した場合であっても医
薬品等の販売等を可能とする。
違反が生じた場合等、保健衛生上の危害の発生又は拡大を防止するために
特に必要な場合には、当該責任役員の変更を命じることができるようにする。 5. 感染症定期報告制度の見直し
○ 医薬品製造販売業者に対し、製造所における製造管理及び品質管理の定 ○ 定期的な報告ではなく、再生医療等製品又は生物由来製品のリスク
が高い場合に速やかに評価・検討結果の報告を求めるとともに、報告対
期的な確認及び情報の収集や、品質保証責任者の設置を義務付ける。
象がない場合は報告を不要とする。
○ 医薬品製造業者に対し、承認申請時に限らず製造管理・品質管理上の基
6. 体外診断用医薬品の特性を踏まえた性能評価
準の遵守を義務付ける。
等
○ 体外診断用医薬品の市販後の性能担保のため、製造販売業者に対し、
2.医薬品安全管理責任者の設置その他の製造販売後安全管理
情報収集、評価、報告を義務付けるとともに、市販後の性能が担保されない
○ 医薬品製造販売業者に対し、医薬品リスク管理計画の作成及び当該
場合には承認を取り消す仕組みを導入する。
計画に基づくリスク管理の実施や、安全管理責任者の設置を義務付ける。 7. 医薬品製造管理者等の要件の見直し
○ リアルワールドデータのみによる再審査又は使用成績評価の申請が可能 ○ 医薬品及び体外診断用医薬品の製造管理者について、薬剤師を置くこと
であることを明確化する。
等
が著しく困難であると認められる場合は薬剤師以外の技術者をもって代えるこ
3.GMP適合性調査の見直し
とができる特例を設ける。
○ 製造所のリスク評価を行い、低リスクと評価された場合は調査不要とし、製造 8. 登録認証制度の安定的な運用に向けた制度の見直し
管理・品質管理上のリスクの高い製造所に対しては高頻度で実地調査を行え ○ 登録認証機関が製造販売業者に対して行う実地調査にPMDAが立ち会っ
るようにする。
等
て助言を行えるようにするとともに、業務の休廃止に関する規定を整備する。
4