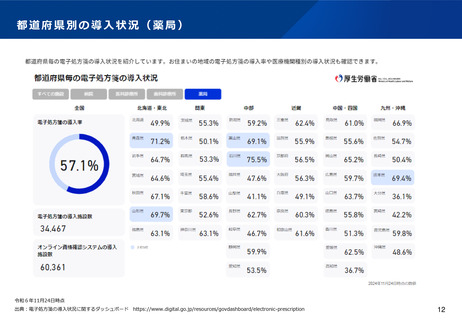
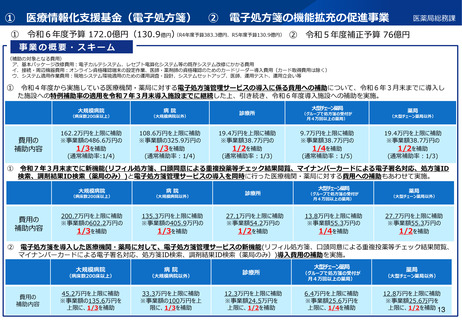
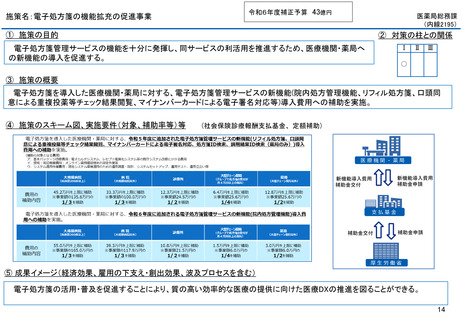
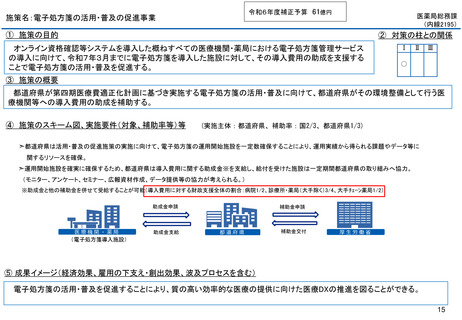
よむ、つかう、まなぶ。
令和6年度 全国厚生労働関係部局長会議(医薬局) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/content/10200000/001391540.pdf |
| 出典情報 | 令和6年度 全国厚生労働関係部局長会議 医薬局(2/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
厚生科学審議会医薬品医療機器制度部会とりまとめ
概要②
②品質の確保された医療用医薬品等の供給
1.医療用医薬品の製造販売業者における安定供給確保に向けた体制
整備
○ 医療用医薬品の製造販売業者に対し、安定供給体制管理責任者の設置
を義務付けるとともに、安定供給のための必要な措置を遵守事項として規定す
る。
2.医療用医薬品の供給不安の迅速な把握、報告徴収及び協力要請等
○ ①医療用医薬品の製造販売業者に対する供給状況報告・供給不安
報告の厚生労働大臣への届出の義務化、②供給不足のおそれがある場
合に製造販売業者又は卸売販売業者に対して厚生労働大臣が製造・
販売等の状況の報告を求めることができる旨の規定、③供給不足のおそ
れがある場合に製造販売業者、卸売販売業者、医療機関又は薬局等に
対して厚生労働大臣が必要な協力の要請ができる旨の規定を設ける。
○ 麻薬卸売業者は一定の場合に隣接する都道府県の区域内にある麻薬
小売業者等に麻薬を譲渡できるようにするとともに、麻薬の回収等のため
の譲渡をできるようにする。
3. 安定供給確保医薬品の供給確保策
○ 安定供給確保医薬品について、専門家の意見を聴いた上で厚生労働大臣
が指定するとともに、生産の促進その他の安定的な供給の確保のために必要な
措置の要請、需給状況の把握のための製造販売業者等に対する報告徴収等
の規定を設ける。
4. 医薬品等の供給不足時の海外代替品へのアクセス改善
○ 既承認医薬品等の供給の不足により医療上の著しい影響が生じる
場合に、外国で流通している代替品について、優先的な承認審査や、
一定期間の外国語表示による包装の容認等を可能とする。
5. 製造方法等の中リスクの変更カテゴリの追加等
○ 製造方法等に係る一部変更のうち、品質に与える影響が大きくない中リ
スク事項に係る変更について、一定期間内で承認するとともに、製造方法
等に係る軽微変更のうち品質に与える影響が少ないものについては、随時
の軽微変更届の代わりに当該変更内容を1年に1回厚生労働大臣に
報告することができるようにする。
○ 安定供給上の対応を含め、科学的に妥当な理由がある場合には、日本
薬局方に不適合な品目についても、個別に承認できる余地を与える。
○ 生物学的製剤や放射性医薬品等の保管のみを行う医薬品の製造所
(市場出荷判定を行う製造所を除く。)及び医薬品等に係る外国製造
業者の製造所について、認定制から登録制にする。
6. 医療用医薬品の需給データを活用したモニタリングの実施
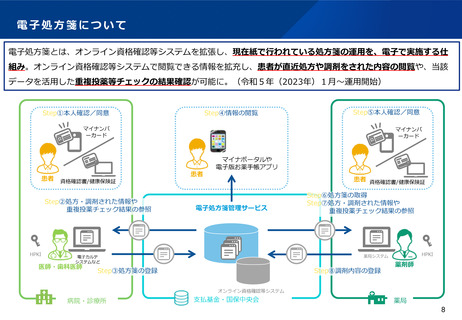
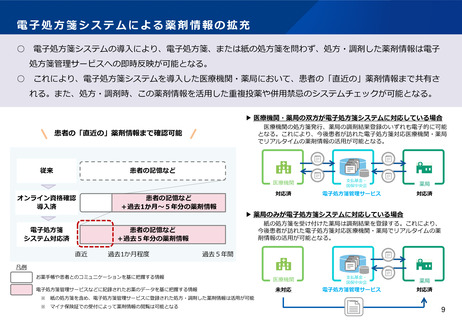
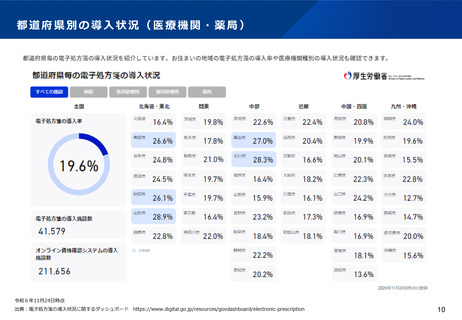
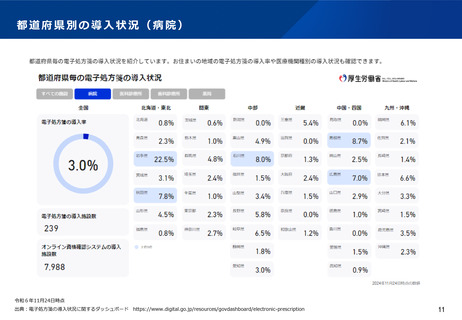
○ 電子処方箋管理サービスのデータについて、医療用医薬品の需給状況
の把握の観点から厚生労働大臣が調査・分析できる旨の規定を設ける。
③ドラッグ・ラグやドラッグ・ロス解消に向けた創薬環境・規制環境の整備
1.小児用医薬品のドラッグ・ロス解消に向けた開発計画策定の促進
○ 成人の医薬品の承認申請者に対して、小児用医薬品開発の計画策定を
努力義務として課すとともに、再審査期間の上限を12年に引き上げる。
2.希少・重篤な疾患に対する医薬品等に係る条件付き承認の見直し
○ 条件付き承認制度について、取消し規定を設けた上で、探索的試験
の段階で、臨床的有用性が合理的に予測可能な場合に承認を与えるこ
とができるようにする。
3. リアルワールドデータの薬事申請への利活用の明確化
○ 様々なデータを受け付ける観点から、医薬品等の承認申請時の添付
資料の規定を一般的なものに改める。
4. 再生医療等製品の特性を踏まえた授与等の例外的許容
○ 自家細胞を用いた再生医療等製品のうち規格外品について、安全性が確
保されていることを前提に、規格外であることにより推定される効果の低下に
比して疾患の重篤性や患者の状態から治療を受ける機会の損失の影響が
5
多大である等の場合に限って授与等を許容する。
概要②
②品質の確保された医療用医薬品等の供給
1.医療用医薬品の製造販売業者における安定供給確保に向けた体制
整備
○ 医療用医薬品の製造販売業者に対し、安定供給体制管理責任者の設置
を義務付けるとともに、安定供給のための必要な措置を遵守事項として規定す
る。
2.医療用医薬品の供給不安の迅速な把握、報告徴収及び協力要請等
○ ①医療用医薬品の製造販売業者に対する供給状況報告・供給不安
報告の厚生労働大臣への届出の義務化、②供給不足のおそれがある場
合に製造販売業者又は卸売販売業者に対して厚生労働大臣が製造・
販売等の状況の報告を求めることができる旨の規定、③供給不足のおそ
れがある場合に製造販売業者、卸売販売業者、医療機関又は薬局等に
対して厚生労働大臣が必要な協力の要請ができる旨の規定を設ける。
○ 麻薬卸売業者は一定の場合に隣接する都道府県の区域内にある麻薬
小売業者等に麻薬を譲渡できるようにするとともに、麻薬の回収等のため
の譲渡をできるようにする。
3. 安定供給確保医薬品の供給確保策
○ 安定供給確保医薬品について、専門家の意見を聴いた上で厚生労働大臣
が指定するとともに、生産の促進その他の安定的な供給の確保のために必要な
措置の要請、需給状況の把握のための製造販売業者等に対する報告徴収等
の規定を設ける。
4. 医薬品等の供給不足時の海外代替品へのアクセス改善
○ 既承認医薬品等の供給の不足により医療上の著しい影響が生じる
場合に、外国で流通している代替品について、優先的な承認審査や、
一定期間の外国語表示による包装の容認等を可能とする。
5. 製造方法等の中リスクの変更カテゴリの追加等
○ 製造方法等に係る一部変更のうち、品質に与える影響が大きくない中リ
スク事項に係る変更について、一定期間内で承認するとともに、製造方法
等に係る軽微変更のうち品質に与える影響が少ないものについては、随時
の軽微変更届の代わりに当該変更内容を1年に1回厚生労働大臣に
報告することができるようにする。
○ 安定供給上の対応を含め、科学的に妥当な理由がある場合には、日本
薬局方に不適合な品目についても、個別に承認できる余地を与える。
○ 生物学的製剤や放射性医薬品等の保管のみを行う医薬品の製造所
(市場出荷判定を行う製造所を除く。)及び医薬品等に係る外国製造
業者の製造所について、認定制から登録制にする。
6. 医療用医薬品の需給データを活用したモニタリングの実施
○ 電子処方箋管理サービスのデータについて、医療用医薬品の需給状況
の把握の観点から厚生労働大臣が調査・分析できる旨の規定を設ける。
③ドラッグ・ラグやドラッグ・ロス解消に向けた創薬環境・規制環境の整備
1.小児用医薬品のドラッグ・ロス解消に向けた開発計画策定の促進
○ 成人の医薬品の承認申請者に対して、小児用医薬品開発の計画策定を
努力義務として課すとともに、再審査期間の上限を12年に引き上げる。
2.希少・重篤な疾患に対する医薬品等に係る条件付き承認の見直し
○ 条件付き承認制度について、取消し規定を設けた上で、探索的試験
の段階で、臨床的有用性が合理的に予測可能な場合に承認を与えるこ
とができるようにする。
3. リアルワールドデータの薬事申請への利活用の明確化
○ 様々なデータを受け付ける観点から、医薬品等の承認申請時の添付
資料の規定を一般的なものに改める。
4. 再生医療等製品の特性を踏まえた授与等の例外的許容
○ 自家細胞を用いた再生医療等製品のうち規格外品について、安全性が確
保されていることを前提に、規格外であることにより推定される効果の低下に
比して疾患の重篤性や患者の状態から治療を受ける機会の損失の影響が
5
多大である等の場合に限って授与等を許容する。