よむ、つかう、まなぶ。
総-3-1薬価算定の基準について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_51409.html |
| 出典情報 | 中央社会保険医療協議会 総会(第604回 2/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
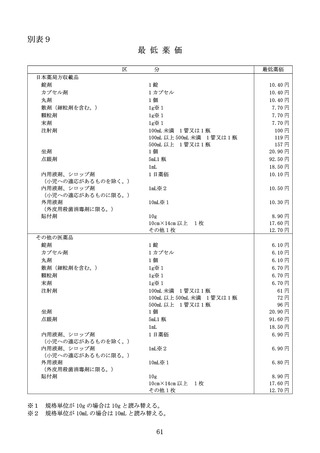
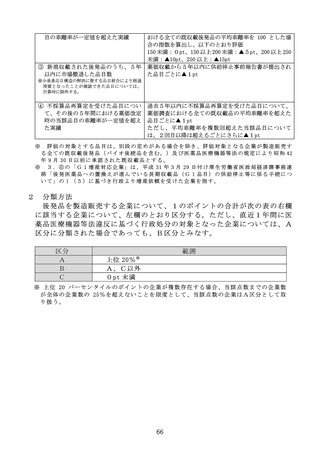
る。)の銘柄数が 10 を超える場合は、100 分の 60 を乗じて得た額)に、当該
バイオ後続品の製造販売業者が承認を申請するに当たって患者を対象に実施
した臨床試験の充実度に応じて、100 分の 10 を上限とする割合を当該額に乗
じて得た額を加えた額を当該新規後発品の薬価とする。
ただし、当該新規収載品が、先発品と組成及び剤形区分が同一のバイオ医
薬品である後発品の場合は、臨床試験の充実度に応じた加算は行わないもの
とする。
ハ
有用性加算(Ⅱ)の対象となる場合
当該新規収載品が有用性加算(Ⅱ)の対象となる場合には、イ又はロの規
定により算定される額に、有用性加算(Ⅱ)を加えた額を当該新規後発品の
薬価とする。
ニ
規格間調整
イからハまでに関わらず、組成、剤形区分及び製造販売業者が同一の汎用
新規収載品と非汎用新規収載品とが同時に薬価収載される場合には、非汎用
新規収載品に該当するものの薬価については、次の数値を用いた規格間調整
により算定する。
(イ)当該新規後発品の有効成分の含有量
(ロ)イからハまでにより算定される当該汎用新規収載品の薬価及び有効成分
の含有量
(ハ)類似薬の規格間比
2
ホ
薬価算定の特例
当該新規後発品に、新薬として収載された既収載品中の最類似薬と有効成
分の含有量が同一の規格がない場合は、当該最類似薬と有効成分の含有量が
同一の規格があるものとして、類似薬効比較方式(Ⅰ)によって算定される
額に 100 分の 50(イのただし書に該当する場合は、100 分の 40)を乗じて得
た額(当該新規後発品がバイオ後続品等に係る特例又は有用性加算(Ⅱ)の
適用を受ける場合には、適用後の額)を算定値とし、当該算定値から規格間
調整により算定される額を当該新規後発品の薬価とする。
へ
最類似薬が新薬創出等加算を受けたことがあり、新薬創出等加算の累積額
の控除を受けていない場合又は最類似薬が第3章第2節に規定する品目であ
り、同規定に基づく控除を受けていない場合は、最類似薬の薬価から、新薬
創出等加算の累積額又は第3章第2節の規定により控除すべき額を控除した
額を当該最類似薬の薬価とみなして、イからホまでの規定を適用する。
新規後発品として薬価収載された既収載品の中に、新規後発品の最類似薬が
ある場合
16
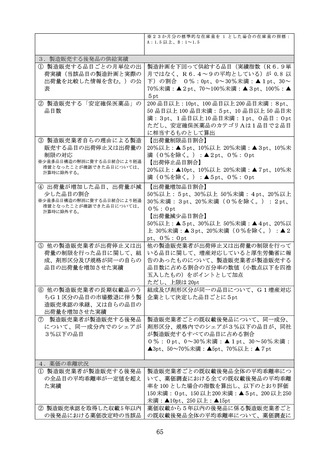
バイオ後続品の製造販売業者が承認を申請するに当たって患者を対象に実施
した臨床試験の充実度に応じて、100 分の 10 を上限とする割合を当該額に乗
じて得た額を加えた額を当該新規後発品の薬価とする。
ただし、当該新規収載品が、先発品と組成及び剤形区分が同一のバイオ医
薬品である後発品の場合は、臨床試験の充実度に応じた加算は行わないもの
とする。
ハ
有用性加算(Ⅱ)の対象となる場合
当該新規収載品が有用性加算(Ⅱ)の対象となる場合には、イ又はロの規
定により算定される額に、有用性加算(Ⅱ)を加えた額を当該新規後発品の
薬価とする。
ニ
規格間調整
イからハまでに関わらず、組成、剤形区分及び製造販売業者が同一の汎用
新規収載品と非汎用新規収載品とが同時に薬価収載される場合には、非汎用
新規収載品に該当するものの薬価については、次の数値を用いた規格間調整
により算定する。
(イ)当該新規後発品の有効成分の含有量
(ロ)イからハまでにより算定される当該汎用新規収載品の薬価及び有効成分
の含有量
(ハ)類似薬の規格間比
2
ホ
薬価算定の特例
当該新規後発品に、新薬として収載された既収載品中の最類似薬と有効成
分の含有量が同一の規格がない場合は、当該最類似薬と有効成分の含有量が
同一の規格があるものとして、類似薬効比較方式(Ⅰ)によって算定される
額に 100 分の 50(イのただし書に該当する場合は、100 分の 40)を乗じて得
た額(当該新規後発品がバイオ後続品等に係る特例又は有用性加算(Ⅱ)の
適用を受ける場合には、適用後の額)を算定値とし、当該算定値から規格間
調整により算定される額を当該新規後発品の薬価とする。
へ
最類似薬が新薬創出等加算を受けたことがあり、新薬創出等加算の累積額
の控除を受けていない場合又は最類似薬が第3章第2節に規定する品目であ
り、同規定に基づく控除を受けていない場合は、最類似薬の薬価から、新薬
創出等加算の累積額又は第3章第2節の規定により控除すべき額を控除した
額を当該最類似薬の薬価とみなして、イからホまでの規定を適用する。
新規後発品として薬価収載された既収載品の中に、新規後発品の最類似薬が
ある場合
16