よむ、つかう、まなぶ。
総-3-1薬価算定の基準について (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_51409.html |
| 出典情報 | 中央社会保険医療協議会 総会(第604回 2/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
なお、安全対策上の必要性により製造方法の変更等を行ったものであって、
当該既収載品の薬価をそのまま適用しては不採算となり、緊急性があるものに
ついては、薬価改定の際に限らず、当該薬価を改定することができる。
3
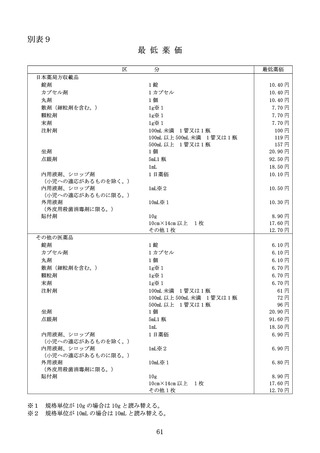
最低薬価
薬価改定の際、本節1又は2の要件に該当しない既収載品について、本規定
の適用前の価格が、別表9の左欄に掲げる薬剤の区分に従い、同表の右欄に掲
げる額(以下「最低薬価」という。)を下回る場合には、最低薬価に改定する。
また、令和7年度薬価改定においては、本節1の要件に該当する既収載品の
薬価が最低薬価を下回る場合、最低薬価に改定する。
なお、価格帯集約を受けた医薬品であって、価格帯のうちいずれかの品目が
最低薬価を下回る場合は、同一の価格帯に含まれる既収載品の中で最も高額な
最低薬価を当該価格帯に含まれる全ての医薬品の最低薬価とする。
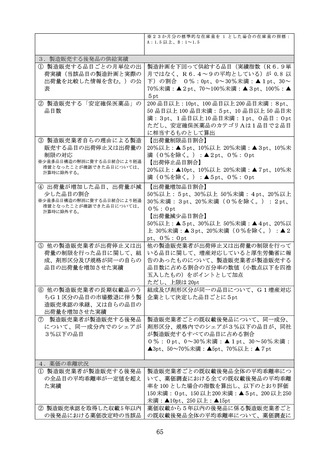
第8節 新薬創出・適応外薬解消等促進加算
1 加算
(1)対象品目
新薬創出・適応外薬解消等促進加算(以下「新薬創出等加算」という。)
の対象品目は、次に掲げる全ての要件に該当する既収載品とする。
イ
新薬として薬価収載され、当該品目に係る後発品が薬価収載されていな
いこと(薬価収載の日から 15 年を経過していないものに限る。)
ロ 次のいずれかの要件に該当すること
① 希少疾病用医薬品として指定された効能又は効果について承認を受け
ている医薬品
② 未承認薬等検討会議における検討結果を踏まえ、厚生労働省が開発を
公募した医薬品
③ 薬価収載の際、画期性加算、有用性加算(Ⅰ)、有用性加算(Ⅱ)若
しくは営業利益率のプラスの補正の対象となった医薬品(第3章第5節
の規定により画期性加算、有用性加算(Ⅰ)若しくは有用性加算(Ⅱ)
の対象となった再生医療等製品を含む。)、薬価改定までに、これらの
加算(有用性加算(Ⅱ)の要件ニのみに該当する場合を除く。)に相当
すると認められる効能又は効果が追加されたもの(既存の効能又は効果
の対象患者の限定を解除したもの等、既存の効能と類似性が高いと認め
られる効能追加等の場合を除く。)又は薬価改定の際、市販後に真の臨
床的有用性が検証された既収載品の薬価の改定の特例を受けた医薬品
(以下「加算適用品」という。)
ただし、組成及び効能又は効果が同等、かつ、製造販売業者が同一の
既収載品から長期間(収載から概ね5年以上)を経て収載されたもので
あって、収載までに時間を要した合理的な理由のないものを除く。
39
当該既収載品の薬価をそのまま適用しては不採算となり、緊急性があるものに
ついては、薬価改定の際に限らず、当該薬価を改定することができる。
3
最低薬価
薬価改定の際、本節1又は2の要件に該当しない既収載品について、本規定
の適用前の価格が、別表9の左欄に掲げる薬剤の区分に従い、同表の右欄に掲
げる額(以下「最低薬価」という。)を下回る場合には、最低薬価に改定する。
また、令和7年度薬価改定においては、本節1の要件に該当する既収載品の
薬価が最低薬価を下回る場合、最低薬価に改定する。
なお、価格帯集約を受けた医薬品であって、価格帯のうちいずれかの品目が
最低薬価を下回る場合は、同一の価格帯に含まれる既収載品の中で最も高額な
最低薬価を当該価格帯に含まれる全ての医薬品の最低薬価とする。
第8節 新薬創出・適応外薬解消等促進加算
1 加算
(1)対象品目
新薬創出・適応外薬解消等促進加算(以下「新薬創出等加算」という。)
の対象品目は、次に掲げる全ての要件に該当する既収載品とする。
イ
新薬として薬価収載され、当該品目に係る後発品が薬価収載されていな
いこと(薬価収載の日から 15 年を経過していないものに限る。)
ロ 次のいずれかの要件に該当すること
① 希少疾病用医薬品として指定された効能又は効果について承認を受け
ている医薬品
② 未承認薬等検討会議における検討結果を踏まえ、厚生労働省が開発を
公募した医薬品
③ 薬価収載の際、画期性加算、有用性加算(Ⅰ)、有用性加算(Ⅱ)若
しくは営業利益率のプラスの補正の対象となった医薬品(第3章第5節
の規定により画期性加算、有用性加算(Ⅰ)若しくは有用性加算(Ⅱ)
の対象となった再生医療等製品を含む。)、薬価改定までに、これらの
加算(有用性加算(Ⅱ)の要件ニのみに該当する場合を除く。)に相当
すると認められる効能又は効果が追加されたもの(既存の効能又は効果
の対象患者の限定を解除したもの等、既存の効能と類似性が高いと認め
られる効能追加等の場合を除く。)又は薬価改定の際、市販後に真の臨
床的有用性が検証された既収載品の薬価の改定の特例を受けた医薬品
(以下「加算適用品」という。)
ただし、組成及び効能又は効果が同等、かつ、製造販売業者が同一の
既収載品から長期間(収載から概ね5年以上)を経て収載されたもので
あって、収載までに時間を要した合理的な理由のないものを除く。
39