よむ、つかう、まなぶ。
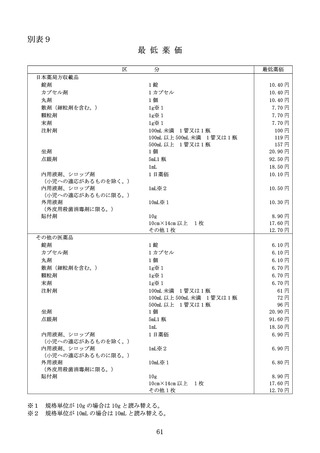
総-3-1薬価算定の基準について (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_51409.html |
| 出典情報 | 中央社会保険医療協議会 総会(第604回 2/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
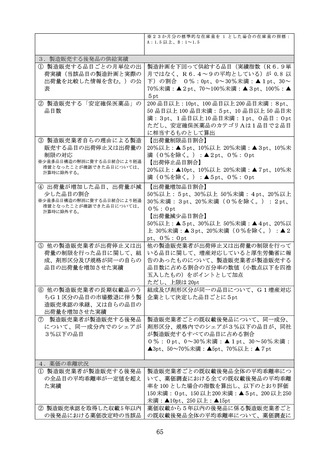
要請された品目について、開発の拒否、合理的な理由のない開発の遅延等、
適切に対応を行わなかった企業
ロ 別表 11 の確認事項について、過去5年いずれの事項にも該当するものが
ない企業
(3)薬価の改定方式
(1)に該当する品目については、(2)に掲げる企業が製造販売するも
のに限り、本規定の適用前の価格に、加算後の価格が改定前薬価となる額を
加算する。
ただし、本規定適用前の価格が改定前薬価を上回る場合及び当該品目の市
場実勢価格の薬価に対する乖離率が全ての既収載品の平均乖離率を超える場
合においては、加算は適用しない。
2
控除
これまで新薬創出等加算を受けたことのある既収載品について、初めて次の
要件のいずれかに該当した場合は、これまで受けた新薬創出等加算の累積額を
本規定の適用前の価格から控除する。
イ 当該既収載品に係る後発品が薬価収載されていること
ロ 薬価収載の日から 15 年を経過していること
ハ 第2章第3部5の規定により薬価算定されることとなる配合剤(補正加算
の対象とならないものに限る。)に相当すると認められるものについては、
薬価収載の日から 15 年を経過した既収載品の有効成分又は後発品が薬価収載
されている既収載品の有効成分を含有するものであること
ニ 1(2)のイ又はロに該当する企業が製造販売するものであること
ホ 1(1)ロ⑪に該当する品目について、先行収載品がイ、ロ、ハ又はニに
該当すること
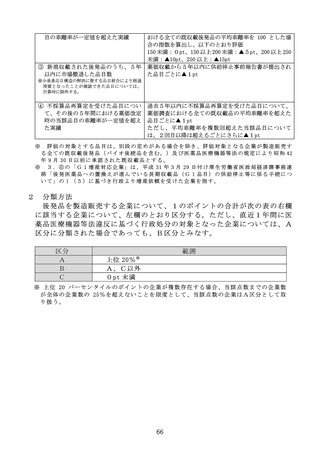
第9節 既収載品の薬価改定時の加算
(1)対象品目
本規定の対象品目は、次のいずれかに該当する品目(令和 7 年度薬価改定に
おいては、令和5年 11 月から令和6年 10 月までの間に該当することとなった
品目に限る。)とする。ただし、第4節1の市場拡大再算定に該当する品目
を除く。
①
小児に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第 15 項(同法第 19 条の2第6項において準
用する場合を含む。以下同じ。)の規定に基づき小児に係る効能又は効果
又は用法及び用量が追加されたもの。ただし、当該効能又は効果等の追加
の承認の申請に当たって、当該申請に係る事項が医学薬学上公知であるこ
とその他の合理的な理由により、臨床試験その他の試験の全部又は一部を
41
適切に対応を行わなかった企業
ロ 別表 11 の確認事項について、過去5年いずれの事項にも該当するものが
ない企業
(3)薬価の改定方式
(1)に該当する品目については、(2)に掲げる企業が製造販売するも
のに限り、本規定の適用前の価格に、加算後の価格が改定前薬価となる額を
加算する。
ただし、本規定適用前の価格が改定前薬価を上回る場合及び当該品目の市
場実勢価格の薬価に対する乖離率が全ての既収載品の平均乖離率を超える場
合においては、加算は適用しない。
2
控除
これまで新薬創出等加算を受けたことのある既収載品について、初めて次の
要件のいずれかに該当した場合は、これまで受けた新薬創出等加算の累積額を
本規定の適用前の価格から控除する。
イ 当該既収載品に係る後発品が薬価収載されていること
ロ 薬価収載の日から 15 年を経過していること
ハ 第2章第3部5の規定により薬価算定されることとなる配合剤(補正加算
の対象とならないものに限る。)に相当すると認められるものについては、
薬価収載の日から 15 年を経過した既収載品の有効成分又は後発品が薬価収載
されている既収載品の有効成分を含有するものであること
ニ 1(2)のイ又はロに該当する企業が製造販売するものであること
ホ 1(1)ロ⑪に該当する品目について、先行収載品がイ、ロ、ハ又はニに
該当すること
第9節 既収載品の薬価改定時の加算
(1)対象品目
本規定の対象品目は、次のいずれかに該当する品目(令和 7 年度薬価改定に
おいては、令和5年 11 月から令和6年 10 月までの間に該当することとなった
品目に限る。)とする。ただし、第4節1の市場拡大再算定に該当する品目
を除く。
①
小児に係る効能又は効果等が追加された既収載品
医薬品医療機器等法第 14 条第 15 項(同法第 19 条の2第6項において準
用する場合を含む。以下同じ。)の規定に基づき小児に係る効能又は効果
又は用法及び用量が追加されたもの。ただし、当該効能又は効果等の追加
の承認の申請に当たって、当該申請に係る事項が医学薬学上公知であるこ
とその他の合理的な理由により、臨床試験その他の試験の全部又は一部を
41