よむ、つかう、まなぶ。
別紙3及び会議後指摘事項に対する回答 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1.
ニューロネティクス社:製造業者
2.
ヴォーパル・テクノロジーズ株式会社:選任製造販売業者
3.
帝人ファーマ株式会社:販売業者
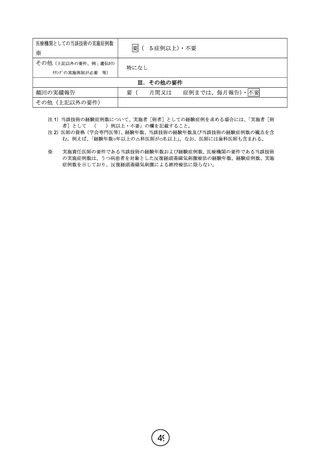
「11.研究の資金源や研究者等の研究に関する利益相反について」では、臨床研究法で規定される
ニューロネティクス社およびヴォーパル・テクノロジーズ株式会社との間に経済的利害関係、雇用関係は
一切ないと記載しています。なお、販売業者である帝人ファーマ株式会社から、講演料を得ている医師
が本研究に参加すること、また、将来参加する可能性があるため、このような記載といたしました。
あわせて、「4.本研究の実施方法及び参加いただく期間」、「2)研究で用いる医薬品/医療機器/
治療法」について、「11.研究の資金源や研究者等の研究に関する利益相反について」の記載整備を
行いました。ご確認ください。
9.試験実施計画書の「7.インフォームド・コンセント等を受ける手続等」ですが、対象者が 18 歳以上
20 歳未満である場合は代諾者とすると記載されています。人を対象とする生命科学・医学系研究に
関する倫理指針のガイダンス(p.109-114)では、16 歳以上の未成年者である場合には、当該特定臨
床研究の対象者の同意に加え、当該対象者の代諾者の同意も得ることとなっており、齟齬があるか
と存じます。(本研究は非特定臨床研究のため努力義務ではありますが、臨床研究法施行規則第
47 条第 2 号にも同旨の規定があります。)計画書において、対象者が 18 歳以上 20 歳未満である場
合は対象者本人の同意に加え、代諾者の同意を得ることと記載を修正してください。また、同意書で
は、本人が 18 歳以上 20 歳未満である場合は代諾者が署名することはわかるように作成されていま
すが、本人の同意署名も必要であることは分からないように思います(そもそも計画書ではそうなっ
ていないようですし。)患者本人が 18 歳以上である場合は本人署名が必要であることが分かるよう
に工夫して頂ければと考えます。また、説明文書に、代諾についての説明を加筆頂きたくお願いいた
します。(なお、本年 4 月以降は民法改正に伴い、成人年齢が 18 歳に引き下げられますが、これ以
降も 18 歳以上 20 歳未満の患者については代諾を併せて取得するという方針であると理解してよろ
しいでしょうか?)
【回答】
ご指摘くださり、ありがとうございました。ご指摘に従い、追記いたしました。試験実施計画書、先進医
療実施届出書、同意説明文書の当該箇所をご確認ください。また、2022 年 4 月以降については、代諾
は併せて取得しない方針です。
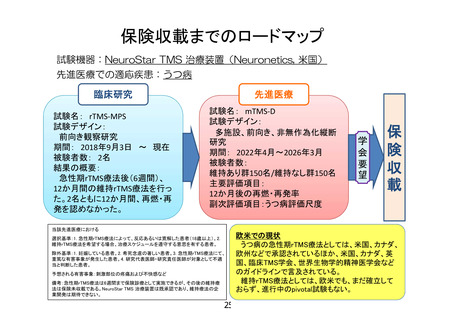
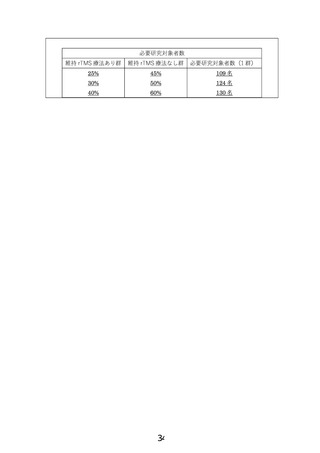
10.当該研究では維持療法群に 150 名、維持療法を実施しない群に 150 名を予定していることを説明
文書に記載頂いた方が、デザインを理解して頂きやすいのではないかと考えます。ご検討ください。
【回答】
ご指摘くださり、ありがとうございました。ご指摘の通りだと思います。「4.本研究の実施方法及び参
加いただく期間」の冒頭に追記いたしました。ご確認ください。
4
18
ニューロネティクス社:製造業者
2.
ヴォーパル・テクノロジーズ株式会社:選任製造販売業者
3.
帝人ファーマ株式会社:販売業者
「11.研究の資金源や研究者等の研究に関する利益相反について」では、臨床研究法で規定される
ニューロネティクス社およびヴォーパル・テクノロジーズ株式会社との間に経済的利害関係、雇用関係は
一切ないと記載しています。なお、販売業者である帝人ファーマ株式会社から、講演料を得ている医師
が本研究に参加すること、また、将来参加する可能性があるため、このような記載といたしました。
あわせて、「4.本研究の実施方法及び参加いただく期間」、「2)研究で用いる医薬品/医療機器/
治療法」について、「11.研究の資金源や研究者等の研究に関する利益相反について」の記載整備を
行いました。ご確認ください。
9.試験実施計画書の「7.インフォームド・コンセント等を受ける手続等」ですが、対象者が 18 歳以上
20 歳未満である場合は代諾者とすると記載されています。人を対象とする生命科学・医学系研究に
関する倫理指針のガイダンス(p.109-114)では、16 歳以上の未成年者である場合には、当該特定臨
床研究の対象者の同意に加え、当該対象者の代諾者の同意も得ることとなっており、齟齬があるか
と存じます。(本研究は非特定臨床研究のため努力義務ではありますが、臨床研究法施行規則第
47 条第 2 号にも同旨の規定があります。)計画書において、対象者が 18 歳以上 20 歳未満である場
合は対象者本人の同意に加え、代諾者の同意を得ることと記載を修正してください。また、同意書で
は、本人が 18 歳以上 20 歳未満である場合は代諾者が署名することはわかるように作成されていま
すが、本人の同意署名も必要であることは分からないように思います(そもそも計画書ではそうなっ
ていないようですし。)患者本人が 18 歳以上である場合は本人署名が必要であることが分かるよう
に工夫して頂ければと考えます。また、説明文書に、代諾についての説明を加筆頂きたくお願いいた
します。(なお、本年 4 月以降は民法改正に伴い、成人年齢が 18 歳に引き下げられますが、これ以
降も 18 歳以上 20 歳未満の患者については代諾を併せて取得するという方針であると理解してよろ
しいでしょうか?)
【回答】
ご指摘くださり、ありがとうございました。ご指摘に従い、追記いたしました。試験実施計画書、先進医
療実施届出書、同意説明文書の当該箇所をご確認ください。また、2022 年 4 月以降については、代諾
は併せて取得しない方針です。
10.当該研究では維持療法群に 150 名、維持療法を実施しない群に 150 名を予定していることを説明
文書に記載頂いた方が、デザインを理解して頂きやすいのではないかと考えます。ご検討ください。
【回答】
ご指摘くださり、ありがとうございました。ご指摘の通りだと思います。「4.本研究の実施方法及び参
加いただく期間」の冒頭に追記いたしました。ご確認ください。
4
18