よむ、つかう、まなぶ。
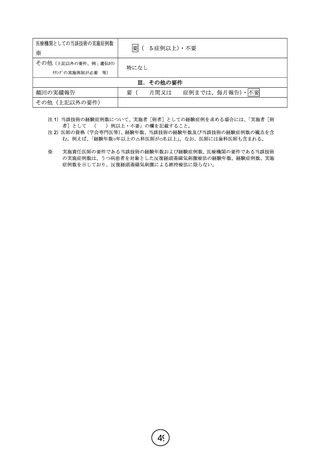
別紙3及び会議後指摘事項に対する回答 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答2
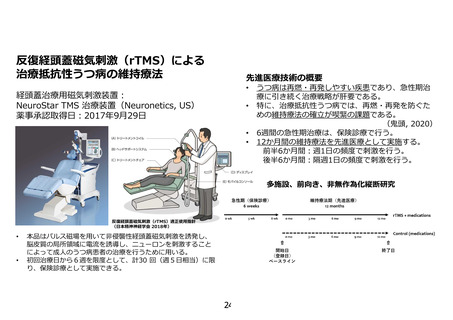
先進医療技術名: 反復経頭蓋磁気刺激による治療抵抗性うつ病の維持療法
2022 年 2 月 15 日
所属・氏名:国立精神・神経医療研究センター 鬼頭伸輔
※照会に伴い変更が生じた場合は、関係書類も併せて修正して下さい。
1.現在、rTMS 治療により反応あるいは寛解した患者さん達が、その後どういった治療を受けている
のか、ご説明頂きたい。
【回答】
ご指摘くださり、ありがとうございます。現況では、保険診療である 6 週間の急性期 rTMS 療法が奏効
した後は、保険診療として継続することができないため、rTMS 療法中に併用していた抗うつ薬を主とし
た薬物療法のみを継続しています。
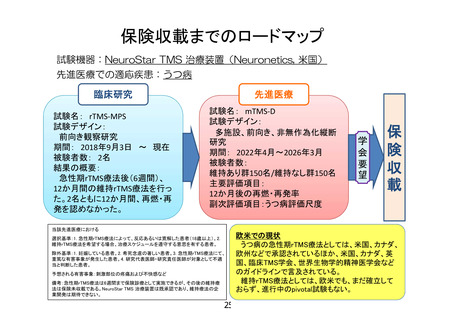
2. 臨床試験のデザインについて、例えば、反応あるいは寛解した対象をランダムに維持治療あるい
は無治療(rTMS を実施しない)に分け、再発・再燃などによる中止までの期間を評価するようなラン
ダム化治療中止試験での評価は実施できないか。
【回答】
ご指摘くださり、どうもありがとうございます。当初、急性期 rTMS 療法が奏効した後、二重盲検無作為
化とし、急性期 rTMS 療法中に併用していた薬物療法は継続したうえで、実刺激群と偽刺激群に割り付
ける試験デザインを検討しておりましたが、以下の理由から、非盲検非無作為化試験としました。
現在、申請者らは、別途 EASyS-BD(jRCTs032180138)を先進医療として進めていますが、こちらの研
究では、週 5 日、4 週間の rTMS 療法を二重盲検無作為化で実施しています(急性期療法)。試験デザ
インは計 20 回のセッション、4 週間の介入期間です。一方、本研究では、計 40 回のセッション、12 か月
間の維持療法期間となっており、EASyS-BD(jRCTs032180138)の経験を通して、セッション数の多さ(計
40 回)、12 か月間にわたる二重盲検無作為化であること、また、一番の理由としては、本研究では維持
rTMS 療法期間に入る前に、全例、急性期 rTMS 療法を受けていることから(実刺激を受けた患者が、実
刺激あるいは偽刺激に割り付けされるため、シャム刺激システムを使用しても判別できる可能性がある)、
実現可能性および盲検妥当性の観点から、本研究で二重盲検無作為化を実施することは困難であると
判断しました。
次に、急性期 rTMS 療法に使用する NeuroStar TMS 治療装置はシャム刺激を実施できず、シャム刺
激を実施できる研究用の装置を入手できないことも理由に挙げられます。
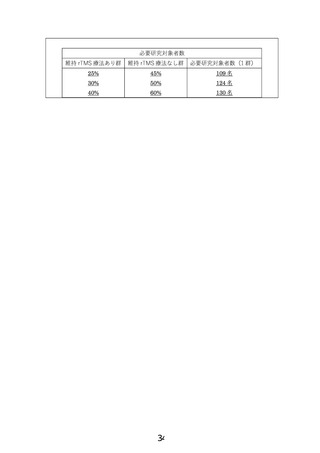
また、rTMS 療法の二重盲検無作為化による検証的試験では、週 5 日、6 週間のデザインの場合、患
者1名あたり 150-200 万円かかる試算となりました(参加施設数、研究期間、委託する CRO により異な
る)。そうしますと、300 名の場合(RCT の場合は 200 名程度まで絞れるが)、4.5-6 億円となり、医療機器
1
8
先進医療技術名: 反復経頭蓋磁気刺激による治療抵抗性うつ病の維持療法
2022 年 2 月 15 日
所属・氏名:国立精神・神経医療研究センター 鬼頭伸輔
※照会に伴い変更が生じた場合は、関係書類も併せて修正して下さい。
1.現在、rTMS 治療により反応あるいは寛解した患者さん達が、その後どういった治療を受けている
のか、ご説明頂きたい。
【回答】
ご指摘くださり、ありがとうございます。現況では、保険診療である 6 週間の急性期 rTMS 療法が奏効
した後は、保険診療として継続することができないため、rTMS 療法中に併用していた抗うつ薬を主とし
た薬物療法のみを継続しています。
2. 臨床試験のデザインについて、例えば、反応あるいは寛解した対象をランダムに維持治療あるい
は無治療(rTMS を実施しない)に分け、再発・再燃などによる中止までの期間を評価するようなラン
ダム化治療中止試験での評価は実施できないか。
【回答】
ご指摘くださり、どうもありがとうございます。当初、急性期 rTMS 療法が奏効した後、二重盲検無作為
化とし、急性期 rTMS 療法中に併用していた薬物療法は継続したうえで、実刺激群と偽刺激群に割り付
ける試験デザインを検討しておりましたが、以下の理由から、非盲検非無作為化試験としました。
現在、申請者らは、別途 EASyS-BD(jRCTs032180138)を先進医療として進めていますが、こちらの研
究では、週 5 日、4 週間の rTMS 療法を二重盲検無作為化で実施しています(急性期療法)。試験デザ
インは計 20 回のセッション、4 週間の介入期間です。一方、本研究では、計 40 回のセッション、12 か月
間の維持療法期間となっており、EASyS-BD(jRCTs032180138)の経験を通して、セッション数の多さ(計
40 回)、12 か月間にわたる二重盲検無作為化であること、また、一番の理由としては、本研究では維持
rTMS 療法期間に入る前に、全例、急性期 rTMS 療法を受けていることから(実刺激を受けた患者が、実
刺激あるいは偽刺激に割り付けされるため、シャム刺激システムを使用しても判別できる可能性がある)、
実現可能性および盲検妥当性の観点から、本研究で二重盲検無作為化を実施することは困難であると
判断しました。
次に、急性期 rTMS 療法に使用する NeuroStar TMS 治療装置はシャム刺激を実施できず、シャム刺
激を実施できる研究用の装置を入手できないことも理由に挙げられます。
また、rTMS 療法の二重盲検無作為化による検証的試験では、週 5 日、6 週間のデザインの場合、患
者1名あたり 150-200 万円かかる試算となりました(参加施設数、研究期間、委託する CRO により異な
る)。そうしますと、300 名の場合(RCT の場合は 200 名程度まで絞れるが)、4.5-6 億円となり、医療機器
1
8