よむ、つかう、まなぶ。
資料1-1 厚生労働省 御提出資料 (13 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/231211/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 12/11)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
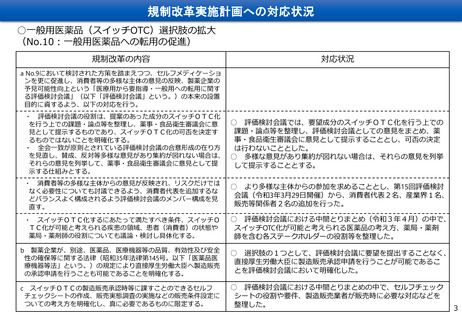
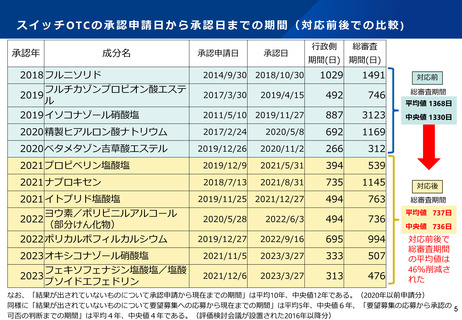
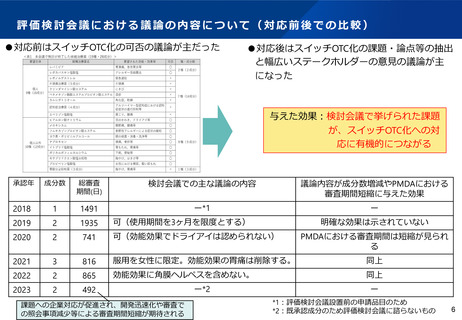
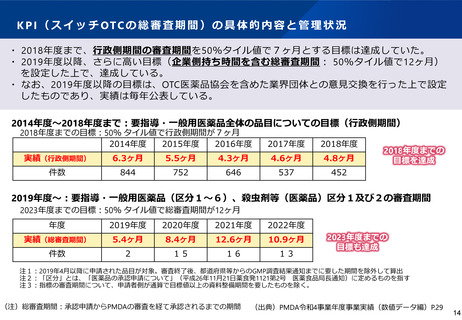
ス イ ッ チ OTC 化 ま で の 審 査 期間 に つい て ( 進捗 を 管理 す る KP I )
「標準的事務処理期間の設定」から「PMDAにおけるスイッチOTC審査期間目標」による管理へ
「標準的事務処理期間の設定等について」(昭和60年10月1日薬発第960号):抜粋(赤字下線を追記)
第一 標準的事務処理期間の設定
1 医薬品、医薬部外品、化粧品及び医療用具の承認等
(1) 都道府県知事が承認申請等を受理した日から、厚生大臣が当該医薬品等に承認等を与える日までにつき、
以下のとおり、標準的事務処理期間を設けることとする。その期間には、提出された書類に不備があり、こ
れを申請者側が補正するのに要する期間及び審議会における指摘事項に対し申請者側が回答するまでの期間
は含まないものとする。
例えば、現在のPMDAによる審査の過程において、
医薬品
医療用
一年
PMDAが開発企業に対して照会事項を送付してから回
一般用 一〇月
答がPMDAに戻ってくるまでの期間(いわゆる「企業
この事務処理期間は現在も適用される
側の持ち時間」)を含まないことを意味している
現在のPMDAの目標
スイッチOTCは区分4。その同一成分は区分5,6
・ 各年度に承認された要指導・一般用医薬品の区分1から6及び殺虫剤等(医薬品)区分1,2の申請から承認までの
総審査期間について、平成35年度(令和5年度)までに50%タイル値で12ヶ月を達成する(ただし、平成31 年4
月以降に申請された品目を対象とし、都道府県等のGMP調査に要した期間及び申請者側が通算で 12 ヶ月以上の資料
整備期間を要したものを除く。)。
出典:「独立行政法人医薬品医療機器総合機構中期計画」(平成31年3月29日厚生労働省発薬生0329第58号認可、令和4年9月27日厚
生労働省発薬生0927第57号変更認可)第1、3(1)<一般用医薬品、医薬部外品審査関係>ア
総審査期間 = 行政側期間 + 企業側持ち時間
(注)総審査期間:承認申請からPMDAの審査を経て承認されるまでの期間 13
「標準的事務処理期間の設定」から「PMDAにおけるスイッチOTC審査期間目標」による管理へ
「標準的事務処理期間の設定等について」(昭和60年10月1日薬発第960号):抜粋(赤字下線を追記)
第一 標準的事務処理期間の設定
1 医薬品、医薬部外品、化粧品及び医療用具の承認等
(1) 都道府県知事が承認申請等を受理した日から、厚生大臣が当該医薬品等に承認等を与える日までにつき、
以下のとおり、標準的事務処理期間を設けることとする。その期間には、提出された書類に不備があり、こ
れを申請者側が補正するのに要する期間及び審議会における指摘事項に対し申請者側が回答するまでの期間
は含まないものとする。
例えば、現在のPMDAによる審査の過程において、
医薬品
医療用
一年
PMDAが開発企業に対して照会事項を送付してから回
一般用 一〇月
答がPMDAに戻ってくるまでの期間(いわゆる「企業
この事務処理期間は現在も適用される
側の持ち時間」)を含まないことを意味している
現在のPMDAの目標
スイッチOTCは区分4。その同一成分は区分5,6
・ 各年度に承認された要指導・一般用医薬品の区分1から6及び殺虫剤等(医薬品)区分1,2の申請から承認までの
総審査期間について、平成35年度(令和5年度)までに50%タイル値で12ヶ月を達成する(ただし、平成31 年4
月以降に申請された品目を対象とし、都道府県等のGMP調査に要した期間及び申請者側が通算で 12 ヶ月以上の資料
整備期間を要したものを除く。)。
出典:「独立行政法人医薬品医療機器総合機構中期計画」(平成31年3月29日厚生労働省発薬生0329第58号認可、令和4年9月27日厚
生労働省発薬生0927第57号変更認可)第1、3(1)<一般用医薬品、医薬部外品審査関係>ア
総審査期間 = 行政側期間 + 企業側持ち時間
(注)総審査期間:承認申請からPMDAの審査を経て承認されるまでの期間 13