よむ、つかう、まなぶ。
資料1-1 厚生労働省 御提出資料 (4 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2310_04medical/231211/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 12/11)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
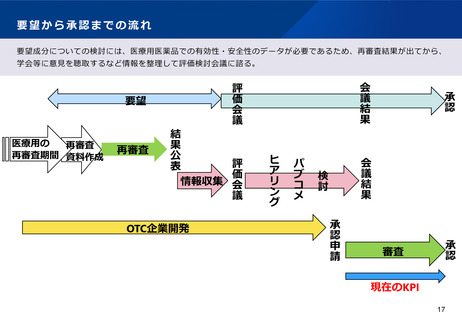
規制改革実施計画への対応状況
○一般用医薬品(スイッチOTC)選択肢の拡大
(No.5:患者のための医薬品アクセスの円滑化)
規制改革の内容
規制改革実施計画(令和4年6月7日閣議決定)
Ⅱ.5.<医療・介護・感染症対策>(3)
対応状況
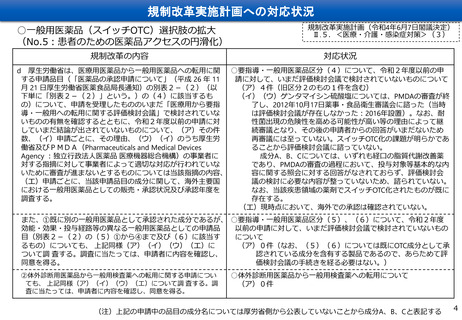
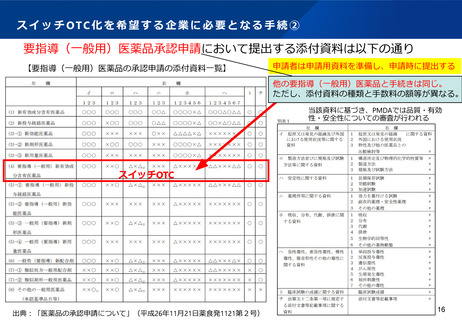
d 厚生労働省は、医療用医薬品から一般用医薬品への転用に関 ○要指導・一般用医薬品区分(4)について、令和2年度以前の申
する申請品目(「医薬品の承認申請について」(平成 26 年 11
請に対して、いまだ評価検討会議で検討されていないものについて
月 21 日厚生労働省医薬食品局長通知)の別表2-(2)(以
(ア)4件(旧区分2のもの1件を含む)
下単に「別表2-(2)」という。)の(4)に該当するも
(イ)(ウ)ゲンタマイシン硫酸塩については、PMDAの審査が終
の)について、申請を受理したもののいまだ「医療用から要指
了し、2012年10月17日薬事・食品衛生審議会に諮った(当時
導・一般用への転用に関する評価検討会議」で検討されていな
は評価検討会議が存在しなかった:2016年設置)。なお、耐
いものの有無を確認するとともに、令和2年度以前の申請に対
性菌出現の危険性を高める可能性が高い等の理由によって継
していまだ結論が出されていないものについて、(ア)その件
続審議となり、その後の申請者からの回答がいまだないため
数、(イ)申請ごとに、その理由、(ウ)(イ)のうち厚生労
再審議には至っていない。スイッチOTC化の課題が明らかであ
働省及びPMDA(Pharmaceuticals and Medical Devices
ることから評価検討会議に諮っていない。
Agency :独立行政法人医薬品 医療機器総合機構)の事業者に
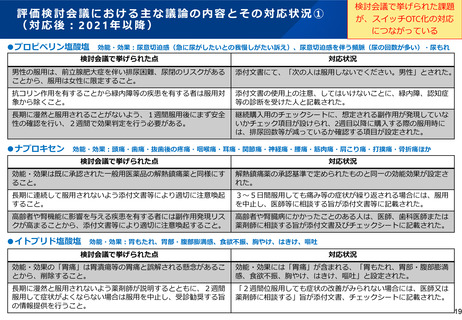
成分A、B、Cについては、いずれも経口の脂質代謝改善薬
対する指摘に対して事業者によって適切な対応が行われていな
であり、PMDAの審査の過程において、投与対象等基本的な内
いために審査が進まないとするものについては当該指摘の内容、
容に関する照会に対する回答がなされておらず、評価検討会
(エ)申請ごとに、当該申請品目の成分に関して、海外主要国
議の検討に必要な内容が整っていないため、諮られていない。
における一般用医薬品としての販売・承認状況及び承認年度を
なお、当該疾患領域の薬剤でスイッチOTC化されたものが既に
存在する。
調査する。
(エ)現時点において、海外での承認は確認されていない。
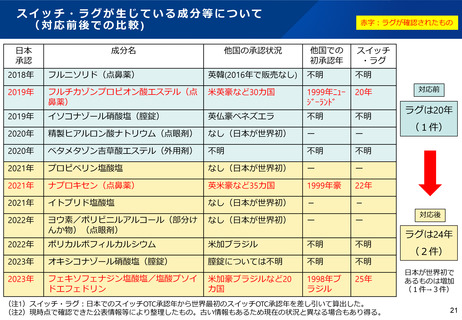
また、①既に別の一般用医薬品として承認された成分であるが、 ○要指導・一般用医薬品区分(5)、(6)について、令和2年度
効能・効果・投与経路等の異なる一般用医薬品としての申請品
以前の申請に対して、いまだ評価検討会議で検討されていないもの
目(別表2-(2)の(5)①から④まで及び(6)に該当す
について
るもの)についても、 上記同様(ア)(イ)(ウ)(エ)に
(ア)0件(なお、(5)(6)については既にOTC成分として承
認されている成分を含有する製品であるので、あらためて評
ついて調 査する。調査に当たっては、申請者に内容を確認し、
同意を得る。
価検討会議の手続きを経る必要はない。)
②体外診断用医薬品から一般用検査薬への転用に関する申請につい
ても、 上記同様(ア)(イ)(ウ)(エ)について調 査する。調
査に当たっては、申請者に内容を確認し、同意を得る。
○体外診断用医薬品から一般用検査薬への転用について
(ア)0件
(注)上記の申請中の品目の成分名については厚労省側から公表していないことから成分A、B、Cと表記する
4
○一般用医薬品(スイッチOTC)選択肢の拡大
(No.5:患者のための医薬品アクセスの円滑化)
規制改革の内容
規制改革実施計画(令和4年6月7日閣議決定)
Ⅱ.5.<医療・介護・感染症対策>(3)
対応状況
d 厚生労働省は、医療用医薬品から一般用医薬品への転用に関 ○要指導・一般用医薬品区分(4)について、令和2年度以前の申
する申請品目(「医薬品の承認申請について」(平成 26 年 11
請に対して、いまだ評価検討会議で検討されていないものについて
月 21 日厚生労働省医薬食品局長通知)の別表2-(2)(以
(ア)4件(旧区分2のもの1件を含む)
下単に「別表2-(2)」という。)の(4)に該当するも
(イ)(ウ)ゲンタマイシン硫酸塩については、PMDAの審査が終
の)について、申請を受理したもののいまだ「医療用から要指
了し、2012年10月17日薬事・食品衛生審議会に諮った(当時
導・一般用への転用に関する評価検討会議」で検討されていな
は評価検討会議が存在しなかった:2016年設置)。なお、耐
いものの有無を確認するとともに、令和2年度以前の申請に対
性菌出現の危険性を高める可能性が高い等の理由によって継
していまだ結論が出されていないものについて、(ア)その件
続審議となり、その後の申請者からの回答がいまだないため
数、(イ)申請ごとに、その理由、(ウ)(イ)のうち厚生労
再審議には至っていない。スイッチOTC化の課題が明らかであ
働省及びPMDA(Pharmaceuticals and Medical Devices
ることから評価検討会議に諮っていない。
Agency :独立行政法人医薬品 医療機器総合機構)の事業者に
成分A、B、Cについては、いずれも経口の脂質代謝改善薬
対する指摘に対して事業者によって適切な対応が行われていな
であり、PMDAの審査の過程において、投与対象等基本的な内
いために審査が進まないとするものについては当該指摘の内容、
容に関する照会に対する回答がなされておらず、評価検討会
(エ)申請ごとに、当該申請品目の成分に関して、海外主要国
議の検討に必要な内容が整っていないため、諮られていない。
における一般用医薬品としての販売・承認状況及び承認年度を
なお、当該疾患領域の薬剤でスイッチOTC化されたものが既に
存在する。
調査する。
(エ)現時点において、海外での承認は確認されていない。
また、①既に別の一般用医薬品として承認された成分であるが、 ○要指導・一般用医薬品区分(5)、(6)について、令和2年度
効能・効果・投与経路等の異なる一般用医薬品としての申請品
以前の申請に対して、いまだ評価検討会議で検討されていないもの
目(別表2-(2)の(5)①から④まで及び(6)に該当す
について
るもの)についても、 上記同様(ア)(イ)(ウ)(エ)に
(ア)0件(なお、(5)(6)については既にOTC成分として承
認されている成分を含有する製品であるので、あらためて評
ついて調 査する。調査に当たっては、申請者に内容を確認し、
同意を得る。
価検討会議の手続きを経る必要はない。)
②体外診断用医薬品から一般用検査薬への転用に関する申請につい
ても、 上記同様(ア)(イ)(ウ)(エ)について調 査する。調
査に当たっては、申請者に内容を確認し、同意を得る。
○体外診断用医薬品から一般用検査薬への転用について
(ア)0件
(注)上記の申請中の品目の成分名については厚労省側から公表していないことから成分A、B、Cと表記する
4