よむ、つかう、まなぶ。
資料3-3 ストラテラカプセル及びストラテラ内用液にて検出された新規ニトロソアミンの限度値について(企業見解)[7.8MB] (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42464.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会安全対策調査会(令和6年度第5回 8/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
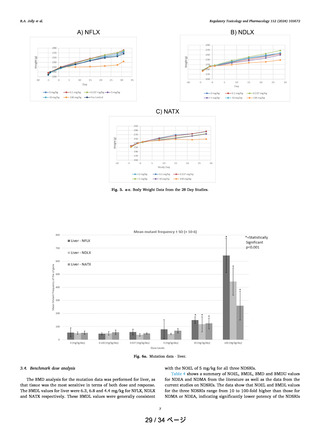
1. 発がん性データのないニトロソアミンについて、Ames 試験とトランスジェニック動
物を用いた遺伝子突然変異試験(TGR 試験)が陽性となった場合、現在のガイダンス
等では AI を 1500 ng/day より大きい値に設定することを許容しておりません。
N-ニトロソアトモキセチンの TGR 試験における無影響量(NOEL)やベンチマーク用
量信頼区間の下限値(BMDL)を発がん試験の NOEL や BMDL と同等に扱っている点
は不適切と考えます。
また、TGR 試験結果から直接 AI を算出していますが、ICH M7(R2)ガイドラインでも
許容されておりません。
(Q&A No. 7.2 参照)
したがって、AI の再検討をお願いいたします。
ご照会の件につきまして、以下のように回答いたします。
<回答>
日本イーライリリー株式会社及び Eli Lilly and Company(以下、Lilly)は、N-ニトロソア
トモキセチンの許容摂取量(AI)は、安全性の観点から、さらに科学的かつ本化合物固有の
データに基づき、4400 ng/day が妥当であると前回の回答と同様に継続して主張する。またそ
れは現在の規制・ガイダンス、特に ICH M7 Q&A No. 7.2 の記載にも一致していると考えて
いる (Jolly et al. 2024)。上述の ICH M7 Q&A No. 7.2 では、
「適切な in vivo 試験の結果は、ケ
ースバイケースでより高い限度値を支持するための、証拠の重み付けに基づく評価に利用可
能なデータを補完しうる」と述べている。しかし、Lilly が提出したような in vivo 遺伝子突然
変異試験の結果のみにおいて、発がんリスク評価を行うことはできない。Lilly はこれまで回
答したように、証拠の重み付けによるアプローチを使用して、4400 ng /day が N-ニトロソア
トモキセチンの安全で適切な AI であると判断した。この証拠の重み付けによるアプローチ
において、Lilly は以下の 4 項目を用いている。
ニトロソアミン類の既知の作用機序
物理的化学的特性に基づくリードアクロス法
量子力学モデル (De et al. 2024) 及び QSARFlex 等の In silico モデル
In vivo 遺伝子突然変異試験
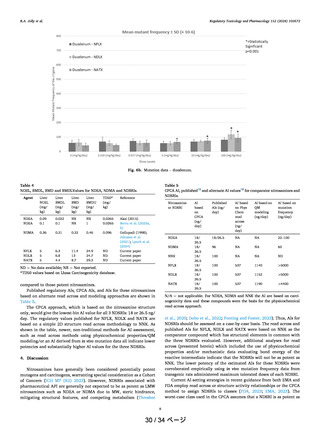
厚生労働省の N-ニトロソアトモキセチンに対する懸念に関して、Lilly は現在の規制・ガ
イダンスには急速に発展するニトロソアミンリスク評価に関して利用できる科学的知見の全
てはまだ反映されていないことを認識している。一方で、Lilly は、N-ニトロソアトモキセチ
ンは強い変異原性を有していない、少なくとも cohort of concern に該当するリスクがあると
見なすべきではないことを示す証拠の重み付けアプローチに基づく確固たる論理を展開し提
供してきた。ICH M7(R2)では、発がん性データがなく、cohort of concern に含まれない変
異原性不純物の毒性学的懸念の閾値(TTC)として、生涯曝露を考慮して 1.5 µg/day(1500
ng/day)を正当化している。当該 TTC においては、発がんリスクは無視できる程度の増加で
あり、過剰発がんリスクは生涯曝露において 10 万分の 1 未満として定義されている。その考
えに基づいて、1500 ng/day を AI として設定することは科学的にも合理的な考え方である。
-2-
9 / 34 ページ
物を用いた遺伝子突然変異試験(TGR 試験)が陽性となった場合、現在のガイダンス
等では AI を 1500 ng/day より大きい値に設定することを許容しておりません。
N-ニトロソアトモキセチンの TGR 試験における無影響量(NOEL)やベンチマーク用
量信頼区間の下限値(BMDL)を発がん試験の NOEL や BMDL と同等に扱っている点
は不適切と考えます。
また、TGR 試験結果から直接 AI を算出していますが、ICH M7(R2)ガイドラインでも
許容されておりません。
(Q&A No. 7.2 参照)
したがって、AI の再検討をお願いいたします。
ご照会の件につきまして、以下のように回答いたします。
<回答>
日本イーライリリー株式会社及び Eli Lilly and Company(以下、Lilly)は、N-ニトロソア
トモキセチンの許容摂取量(AI)は、安全性の観点から、さらに科学的かつ本化合物固有の
データに基づき、4400 ng/day が妥当であると前回の回答と同様に継続して主張する。またそ
れは現在の規制・ガイダンス、特に ICH M7 Q&A No. 7.2 の記載にも一致していると考えて
いる (Jolly et al. 2024)。上述の ICH M7 Q&A No. 7.2 では、
「適切な in vivo 試験の結果は、ケ
ースバイケースでより高い限度値を支持するための、証拠の重み付けに基づく評価に利用可
能なデータを補完しうる」と述べている。しかし、Lilly が提出したような in vivo 遺伝子突然
変異試験の結果のみにおいて、発がんリスク評価を行うことはできない。Lilly はこれまで回
答したように、証拠の重み付けによるアプローチを使用して、4400 ng /day が N-ニトロソア
トモキセチンの安全で適切な AI であると判断した。この証拠の重み付けによるアプローチ
において、Lilly は以下の 4 項目を用いている。
ニトロソアミン類の既知の作用機序
物理的化学的特性に基づくリードアクロス法
量子力学モデル (De et al. 2024) 及び QSARFlex 等の In silico モデル
In vivo 遺伝子突然変異試験
厚生労働省の N-ニトロソアトモキセチンに対する懸念に関して、Lilly は現在の規制・ガ
イダンスには急速に発展するニトロソアミンリスク評価に関して利用できる科学的知見の全
てはまだ反映されていないことを認識している。一方で、Lilly は、N-ニトロソアトモキセチ
ンは強い変異原性を有していない、少なくとも cohort of concern に該当するリスクがあると
見なすべきではないことを示す証拠の重み付けアプローチに基づく確固たる論理を展開し提
供してきた。ICH M7(R2)では、発がん性データがなく、cohort of concern に含まれない変
異原性不純物の毒性学的懸念の閾値(TTC)として、生涯曝露を考慮して 1.5 µg/day(1500
ng/day)を正当化している。当該 TTC においては、発がんリスクは無視できる程度の増加で
あり、過剰発がんリスクは生涯曝露において 10 万分の 1 未満として定義されている。その考
えに基づいて、1500 ng/day を AI として設定することは科学的にも合理的な考え方である。
-2-
9 / 34 ページ