よむ、つかう、まなぶ。
資料4:臨床研究・治験推進に係る今後の方向性について (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
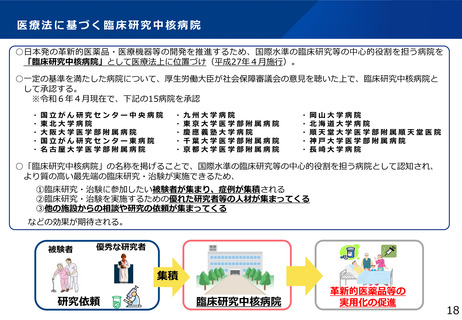
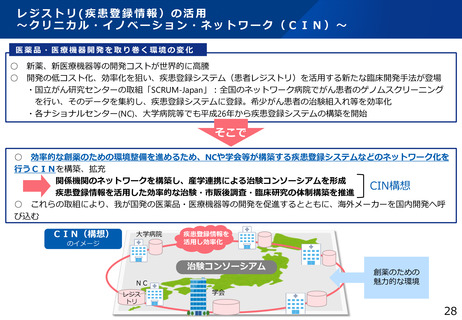
医療法に基づく臨床研究中核病院
○日本発の革新的医薬品・医療機器等の開発を推進するため、国際水準の臨床研究等の中心的役割を担う病院を
「臨床研究中核病院」として医療法上に位置づけ(平成27年4月施行)。
○一定の基準を満たした病院について、厚生労働大臣が社会保障審議会の意見を聴いた上で、臨床研究中核病院と
して承認する。
※令和6年4月現在で、下記の15病院を承認
・国立がん研究センター中央病院
・東北大学病院
・大阪大学医学部附属病院
・国立がん研究センター東病院
・名古屋大学医学部附属病院
・九州大学病院
・東京大学医学部附属病院
・慶應義塾大学病院
・千葉大学医学部附属病院
・京都大学医学部附属病院
・岡山大学病院
・北海道大学病院
・順天堂大学医学部附属順天堂医院
・神戸大学医学部附属病院
・長崎大学病院
○「臨床研究中核病院」の名称を掲げることで、国際水準の臨床研究等の中心的役割を担う病院として認知され、
より質の高い最先端の臨床研究・治験が実施できるため、
①臨床研究・治験に参加したい被験者が集まり、症例が集積される
②臨床研究・治験を実施するための優れた研究者等の人材が集まってくる
③他の施設からの相談や研究の依頼が集まってくる
などの効果が期待される。
被験者
優秀な研究者
集積
研究依頼
臨床研究中核病院
革新的医薬品等の
実用化の促進
18
○日本発の革新的医薬品・医療機器等の開発を推進するため、国際水準の臨床研究等の中心的役割を担う病院を
「臨床研究中核病院」として医療法上に位置づけ(平成27年4月施行)。
○一定の基準を満たした病院について、厚生労働大臣が社会保障審議会の意見を聴いた上で、臨床研究中核病院と
して承認する。
※令和6年4月現在で、下記の15病院を承認
・国立がん研究センター中央病院
・東北大学病院
・大阪大学医学部附属病院
・国立がん研究センター東病院
・名古屋大学医学部附属病院
・九州大学病院
・東京大学医学部附属病院
・慶應義塾大学病院
・千葉大学医学部附属病院
・京都大学医学部附属病院
・岡山大学病院
・北海道大学病院
・順天堂大学医学部附属順天堂医院
・神戸大学医学部附属病院
・長崎大学病院
○「臨床研究中核病院」の名称を掲げることで、国際水準の臨床研究等の中心的役割を担う病院として認知され、
より質の高い最先端の臨床研究・治験が実施できるため、
①臨床研究・治験に参加したい被験者が集まり、症例が集積される
②臨床研究・治験を実施するための優れた研究者等の人材が集まってくる
③他の施設からの相談や研究の依頼が集まってくる
などの効果が期待される。
被験者
優秀な研究者
集積
研究依頼
臨床研究中核病院
革新的医薬品等の
実用化の促進
18