よむ、つかう、まなぶ。
資料4:臨床研究・治験推進に係る今後の方向性について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
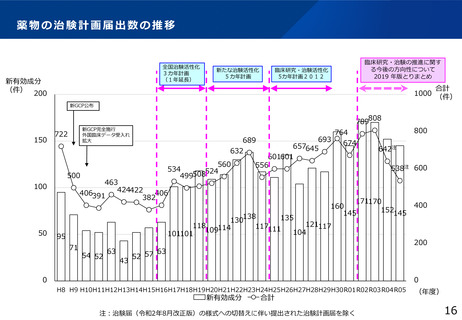
「臨床研究・治験の推進に関する今後の方向性について
内容
2019年版とりまとめ」
<背景>
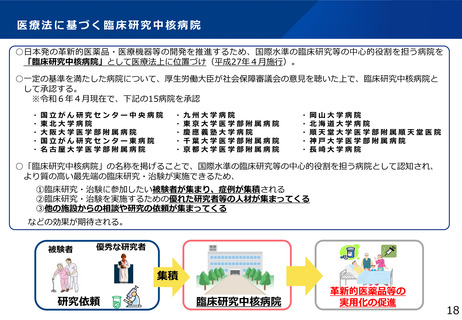
平成27年に臨床研究中核病院を医療法(昭和23 年法律第205 号)に位置付ける等の臨床研究・治
験を取り巻く環境の変化
<対応>
厚生科学審議会臨床研究部会において、今後の臨床研究・治験活性化施策について議論し、以下の
通り、臨床研究・治験の推進に係る五つの基本的考え方をまとめた。
Ⅰ
「新薬・新医療機器等の開発」と「診
療の最適化のための研究」のバランス
Ⅱ
人材育成の強化と財政的リソースの効
率化
Ⅲ
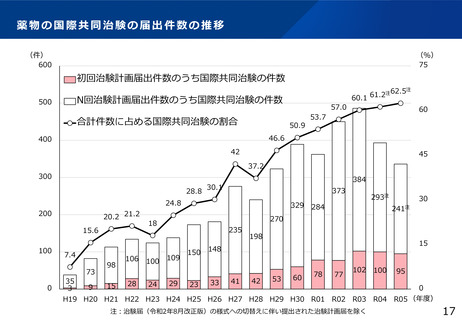
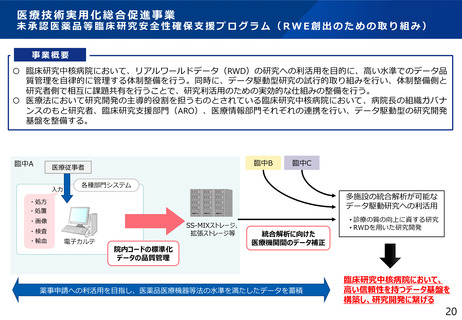
リアルワールドデータの利活用促進
⚫ 革新的な医薬品、医療機器等の研究開発
の推進
⚫ 質の高い医療の提供には、市販された医
薬品同士を比較し診療ガイドラインの改
善につなげることや、医薬品を用いない
手術・手技に係る研究など、診療の最適
化に係る臨床研究も行うこと
⚫ 研究実施に加え、研究開発を支える人材
育成を強化するとともに、人材等のリ
ソースをより一層効率的に活用すること
⚫ 臨床研究中核病院とその支援先機関に求
められる役割や体制を整理するとともに、
研究者及び研究支援人材の質向上も含め、
研究開発の効率性を高めること
⚫ 質の高い診療・研究の実現や、特に高い
資源投入が要求される開発後期の臨床試
験規模の適正化等を図るため、欧米と同
様、薬事分野をはじめとして、リアル
ワールドデータの利活用を促進すること
Ⅳ 小児疾病・難病等の研究開発が進みに
くい領域の取組
Ⅴ 国民・患者の理解や参画促進
○
⚫ 既存の臨床研究中核病院や製薬企業等に
よる取組の下では、必要とされる研究開
発がなかなか進まない疾病領域、すなわ
ち小児疾病や難病等の重要な領域の臨床
研究・治験に関して、国として、領域を
特定した取組を行うこと
⚫ 国民・患者の臨床研究・治験への理解や
参画が十分でないことも臨床研究・治験
を進める上で課題となっているとの指摘
⚫ 国民・患者の臨床研究・治験に関する理
解や参画を促す取組を行うこと
⚫ 臨床研究法の運用改善
⚫ 認定臨床研究審査委員会の質の平準化
⚫ 一般の立場から意見を述べる委員及び意
見集約を行う委員長向けの研修
⚫ 特定臨床研究の薬事活用
⚫ 国際共同臨床試験の体制整備など
その他
3
内容
2019年版とりまとめ」
<背景>
平成27年に臨床研究中核病院を医療法(昭和23 年法律第205 号)に位置付ける等の臨床研究・治
験を取り巻く環境の変化
<対応>
厚生科学審議会臨床研究部会において、今後の臨床研究・治験活性化施策について議論し、以下の
通り、臨床研究・治験の推進に係る五つの基本的考え方をまとめた。
Ⅰ
「新薬・新医療機器等の開発」と「診
療の最適化のための研究」のバランス
Ⅱ
人材育成の強化と財政的リソースの効
率化
Ⅲ
リアルワールドデータの利活用促進
⚫ 革新的な医薬品、医療機器等の研究開発
の推進
⚫ 質の高い医療の提供には、市販された医
薬品同士を比較し診療ガイドラインの改
善につなげることや、医薬品を用いない
手術・手技に係る研究など、診療の最適
化に係る臨床研究も行うこと
⚫ 研究実施に加え、研究開発を支える人材
育成を強化するとともに、人材等のリ
ソースをより一層効率的に活用すること
⚫ 臨床研究中核病院とその支援先機関に求
められる役割や体制を整理するとともに、
研究者及び研究支援人材の質向上も含め、
研究開発の効率性を高めること
⚫ 質の高い診療・研究の実現や、特に高い
資源投入が要求される開発後期の臨床試
験規模の適正化等を図るため、欧米と同
様、薬事分野をはじめとして、リアル
ワールドデータの利活用を促進すること
Ⅳ 小児疾病・難病等の研究開発が進みに
くい領域の取組
Ⅴ 国民・患者の理解や参画促進
○
⚫ 既存の臨床研究中核病院や製薬企業等に
よる取組の下では、必要とされる研究開
発がなかなか進まない疾病領域、すなわ
ち小児疾病や難病等の重要な領域の臨床
研究・治験に関して、国として、領域を
特定した取組を行うこと
⚫ 国民・患者の臨床研究・治験への理解や
参画が十分でないことも臨床研究・治験
を進める上で課題となっているとの指摘
⚫ 国民・患者の臨床研究・治験に関する理
解や参画を促す取組を行うこと
⚫ 臨床研究法の運用改善
⚫ 認定臨床研究審査委員会の質の平準化
⚫ 一般の立場から意見を述べる委員及び意
見集約を行う委員長向けの研修
⚫ 特定臨床研究の薬事活用
⚫ 国際共同臨床試験の体制整備など
その他
3