よむ、つかう、まなぶ。
資料4:臨床研究・治験推進に係る今後の方向性について (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
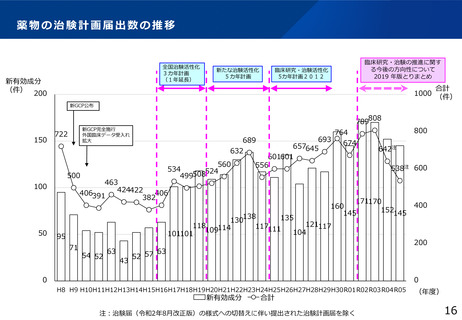
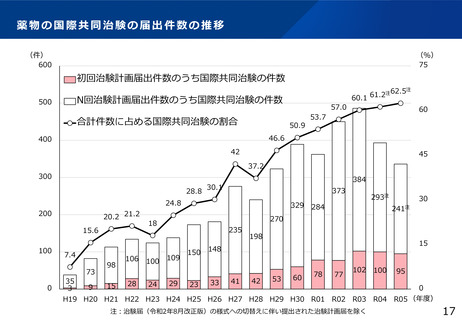
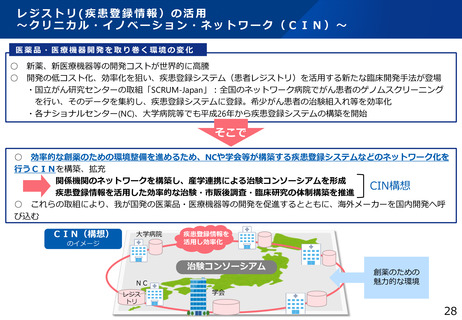
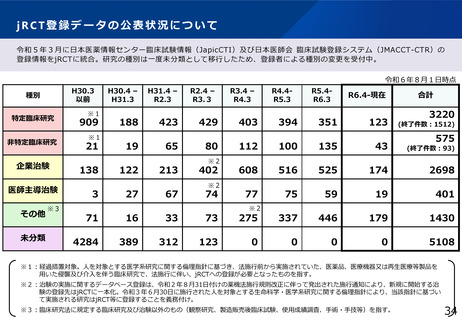
jRCT登録データの公表状況について
令和5年3月に日本医薬情報センター臨床試験情報(JapicCTI)及び日本医師会 臨床試験登録システム(JMACCT-CTR)の
登録情報をjRCTに統合。研究の種別は一度未分類として移行したため、登録者による種別の変更を受付中。
令和6年8月1日時点
H30.3
以前
種別
特定臨床研究
非特定臨床研究
企業治験
医師主導治験
その他
未分類
※3
※1
909
※1
21
138
3
H30.4 –
H31.3
H31.4 –
R2.3
R2.4 –
R3.3
R3.4 –
R4.3
188
423
429
403
19
122
27
65
213
67
80
※2
402
※2
74
R4.4R5.3
394
R5.4R6.3
351
R6.4-現在
123
合計
3220
(終了件数:1512)
575
112
100
135
43
(終了件数:93)
608
516
525
174
2698
77
75
59
19
401
※2
71
16
33
73
275
337
446
179
1430
4284
389
312
123
0
0
0
0
5108
※1:経過措置対象。人を対象とする医学系研究に関する倫理指針に基づき、法施行前から実施されていた、医薬品、医療機器又は再生医療等製品を
用いた侵襲及び介入を伴う臨床研究で、法施行に伴い、jRCTへの登録が必要となったものを指す。
※2:治験の実施に関するデータベース登録は、令和2年8月31日付けの薬機法施行規則改正に伴って発出された施行通知により、新規に開始する治
験の登録先はjRCTに一本化。令和3年6月30日に施行された人を対象とする生命科学・医学系研究に関する倫理指針により、当該指針に基づい
て実施される研究はjRCT等に登録することを義務付け。
※3:臨床研究法に規定する臨床研究及び治験以外のもの(観察研究、製造販売後臨床試験、使用成績調査、手術・手技等)を指す。
34
令和5年3月に日本医薬情報センター臨床試験情報(JapicCTI)及び日本医師会 臨床試験登録システム(JMACCT-CTR)の
登録情報をjRCTに統合。研究の種別は一度未分類として移行したため、登録者による種別の変更を受付中。
令和6年8月1日時点
H30.3
以前
種別
特定臨床研究
非特定臨床研究
企業治験
医師主導治験
その他
未分類
※3
※1
909
※1
21
138
3
H30.4 –
H31.3
H31.4 –
R2.3
R2.4 –
R3.3
R3.4 –
R4.3
188
423
429
403
19
122
27
65
213
67
80
※2
402
※2
74
R4.4R5.3
394
R5.4R6.3
351
R6.4-現在
123
合計
3220
(終了件数:1512)
575
112
100
135
43
(終了件数:93)
608
516
525
174
2698
77
75
59
19
401
※2
71
16
33
73
275
337
446
179
1430
4284
389
312
123
0
0
0
0
5108
※1:経過措置対象。人を対象とする医学系研究に関する倫理指針に基づき、法施行前から実施されていた、医薬品、医療機器又は再生医療等製品を
用いた侵襲及び介入を伴う臨床研究で、法施行に伴い、jRCTへの登録が必要となったものを指す。
※2:治験の実施に関するデータベース登録は、令和2年8月31日付けの薬機法施行規則改正に伴って発出された施行通知により、新規に開始する治
験の登録先はjRCTに一本化。令和3年6月30日に施行された人を対象とする生命科学・医学系研究に関する倫理指針により、当該指針に基づい
て実施される研究はjRCT等に登録することを義務付け。
※3:臨床研究法に規定する臨床研究及び治験以外のもの(観察研究、製造販売後臨床試験、使用成績調査、手術・手技等)を指す。
34