よむ、つかう、まなぶ。
資料4:臨床研究・治験推進に係る今後の方向性について (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
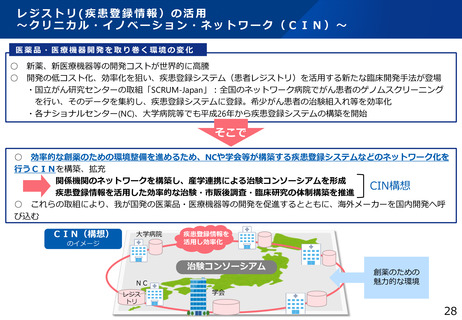
認定臨床研究審査委員会の質向上に向けた取組
○ 平成30年4月から臨床研究法が施行。未承認・適応外の医薬品等を用いるなどの特定臨床研究については、国が一
定の要件を満たすことを認定した「認定臨床研究審査委員会(CRB)」における審査が義務付けられた。
○ 現在、約90のCRBが認定されているが、それぞれの審査能力にばらつきがあることが指摘されている。我が国の臨
床研究の質の向上のため、CRB全体の審査能力の向上を目指し、事業を実施。
臨床研究審査委員会審査能力向上促進事業
臨床研究総合促進事業
模擬審査等事業
特定臨床研究等の審査手続・運用等
の施行状況調査事業
CRB質向上プログラム
模擬の研究計画に係る審査資料一式を作
成し、評価対象CRBに対して実際に審査
申請を行い、審査過程を評価する。審査
における改善点を抽出し、被評価CRBに
フィードバックする。(H30~R4)
体制及び審査意見業務について、法令に
基づく基準を満たしているかの調査
(H30~R2)
CRBに対して、CRBの設置理由や研究支
援内容等の調査(H31~R2)
議事録審査事業
認定臨床研究審査委員会
評価指標調査事業
臨床研究中核病院を中心とした
CRBを対象に、相互にCRBの審査
内容を評価し合う相互評価を順
次実施することで、CRB毎の審
議の内容の均質化や質の向上を
図る。
評価対象CRBから議事録等を含めた審査
資料一式を入手し、審査内容を評価する。
有識者からの意見を集約し、被評価CRB
にフィードバックする。(R5~R6)
米英仏を中心に各国の研究審査委員会の
規制や要件を調査(R4)
審査能力の向上・臨床研究の質の確保
R4~R5は臨床研究中核病院同士
のCRBを対象に実施し、R6から
臨床研究中核病院以外のCRBに
対象を広げて実施。本事業で作
成した成果物を自己チェックの
ツールとして公表。
( R4~R6 )
24
○ 平成30年4月から臨床研究法が施行。未承認・適応外の医薬品等を用いるなどの特定臨床研究については、国が一
定の要件を満たすことを認定した「認定臨床研究審査委員会(CRB)」における審査が義務付けられた。
○ 現在、約90のCRBが認定されているが、それぞれの審査能力にばらつきがあることが指摘されている。我が国の臨
床研究の質の向上のため、CRB全体の審査能力の向上を目指し、事業を実施。
臨床研究審査委員会審査能力向上促進事業
臨床研究総合促進事業
模擬審査等事業
特定臨床研究等の審査手続・運用等
の施行状況調査事業
CRB質向上プログラム
模擬の研究計画に係る審査資料一式を作
成し、評価対象CRBに対して実際に審査
申請を行い、審査過程を評価する。審査
における改善点を抽出し、被評価CRBに
フィードバックする。(H30~R4)
体制及び審査意見業務について、法令に
基づく基準を満たしているかの調査
(H30~R2)
CRBに対して、CRBの設置理由や研究支
援内容等の調査(H31~R2)
議事録審査事業
認定臨床研究審査委員会
評価指標調査事業
臨床研究中核病院を中心とした
CRBを対象に、相互にCRBの審査
内容を評価し合う相互評価を順
次実施することで、CRB毎の審
議の内容の均質化や質の向上を
図る。
評価対象CRBから議事録等を含めた審査
資料一式を入手し、審査内容を評価する。
有識者からの意見を集約し、被評価CRB
にフィードバックする。(R5~R6)
米英仏を中心に各国の研究審査委員会の
規制や要件を調査(R4)
審査能力の向上・臨床研究の質の確保
R4~R5は臨床研究中核病院同士
のCRBを対象に実施し、R6から
臨床研究中核病院以外のCRBに
対象を広げて実施。本事業で作
成した成果物を自己チェックの
ツールとして公表。
( R4~R6 )
24