よむ、つかう、まなぶ。
資料4:臨床研究・治験推進に係る今後の方向性について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
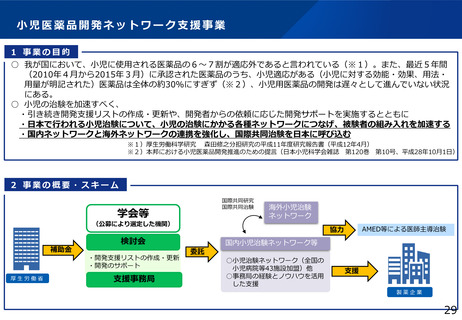
臨床研究・治験推進研究事業
事業の概要
○ 有望な医薬品シーズがアカデミアや企業で見いだされても、その後の臨床研究や治験を効率的に実施しなけれ
ば、早期の薬事承認に繋がらない。
○ 日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出するため、科学性及び倫理性
が十分に担保され得る質の高い臨床研究・医師主導治験を推進する。
<支援に係る主なコンセプト>
① 患者ニーズの高いもの
疾患の希少性、不採算性等を総合的に考慮し、公益性の高い
特定臨床研究・医師主導治験を支援
➢
➢
➢
➢
➢
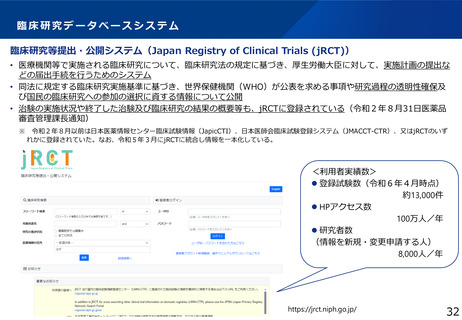
臨床研究・治験の推進
臨床研究・医師主導治験のプロトコール作成
特定臨床研究の実施
医師主導治験(新有効成分、新効能、新用量医薬品)の実施
小児を対象とした特定臨床研究・医師主導治験の実施
認知症を対象とした特定臨床研究・医師主導治験等の実施
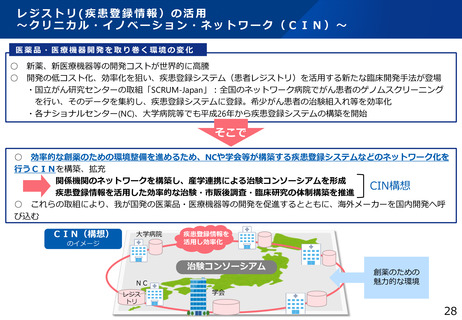
② 疾患登録システム(患者レジストリ)等の活用
疾患登録システムを、薬事承認申請に利用可能な比較対照群等に利活用する、特定
臨床研究・医師主導治験の実施を支援
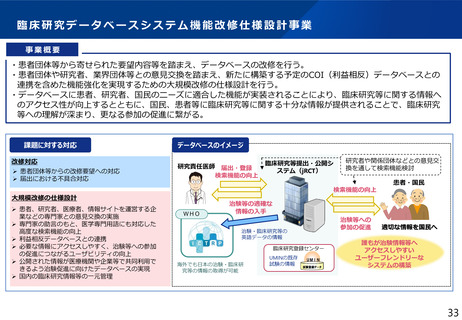
③ Decentralized Clinical Trial(DCT)等の新しい手法の活用
デジタルデバイス、オンライン診療等の新しい技術や訪問診療等を活用し、被験者
の安全性やデータの信頼性を担保しつつ、被験者や関係者の負担を軽減し得る臨床
試験(Decentralized Clinical Trial;分散型臨床試験)等の新しい手法を活用した
特定臨床研究・医師主導治験のプロトコール作成、実施を支援
25
事業の概要
○ 有望な医薬品シーズがアカデミアや企業で見いだされても、その後の臨床研究や治験を効率的に実施しなけれ
ば、早期の薬事承認に繋がらない。
○ 日本で生み出された基礎研究の成果を薬事承認につなげ、革新的な医薬品を創出するため、科学性及び倫理性
が十分に担保され得る質の高い臨床研究・医師主導治験を推進する。
<支援に係る主なコンセプト>
① 患者ニーズの高いもの
疾患の希少性、不採算性等を総合的に考慮し、公益性の高い
特定臨床研究・医師主導治験を支援
➢
➢
➢
➢
➢
臨床研究・治験の推進
臨床研究・医師主導治験のプロトコール作成
特定臨床研究の実施
医師主導治験(新有効成分、新効能、新用量医薬品)の実施
小児を対象とした特定臨床研究・医師主導治験の実施
認知症を対象とした特定臨床研究・医師主導治験等の実施
② 疾患登録システム(患者レジストリ)等の活用
疾患登録システムを、薬事承認申請に利用可能な比較対照群等に利活用する、特定
臨床研究・医師主導治験の実施を支援
③ Decentralized Clinical Trial(DCT)等の新しい手法の活用
デジタルデバイス、オンライン診療等の新しい技術や訪問診療等を活用し、被験者
の安全性やデータの信頼性を担保しつつ、被験者や関係者の負担を軽減し得る臨床
試験(Decentralized Clinical Trial;分散型臨床試験)等の新しい手法を活用した
特定臨床研究・医師主導治験のプロトコール作成、実施を支援
25