よむ、つかう、まなぶ。
薬ー1令和7年度薬価改定について⓸ (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47090.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第231回 12/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
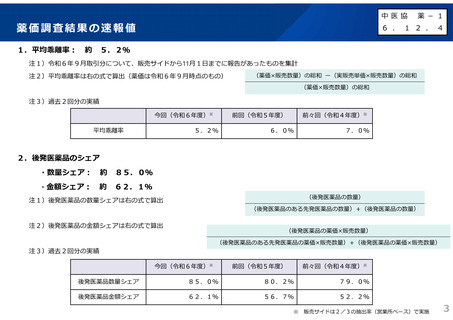
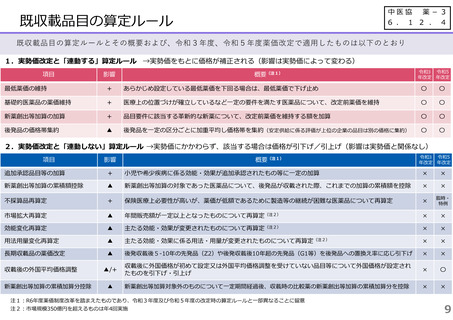
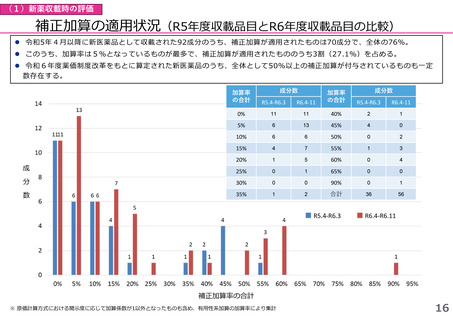
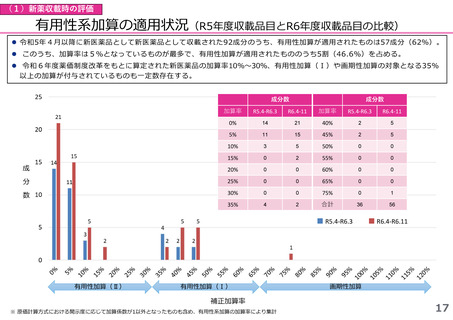
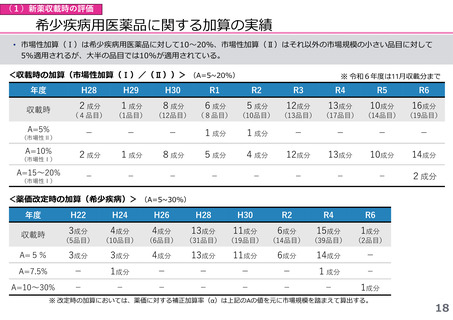
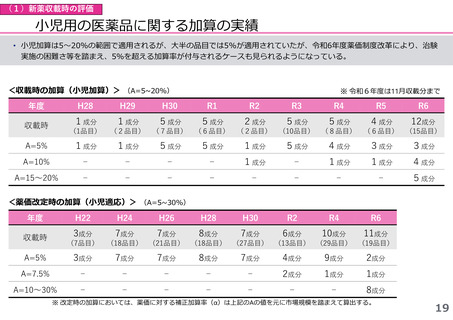
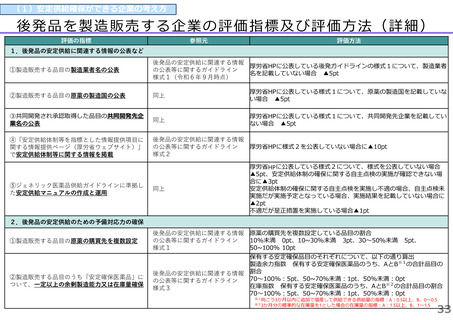
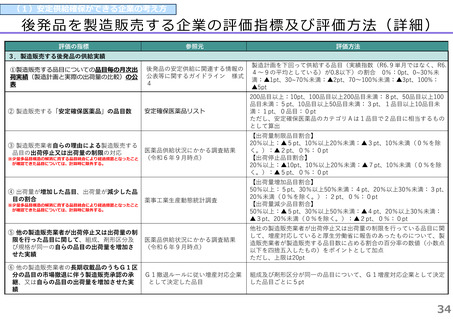
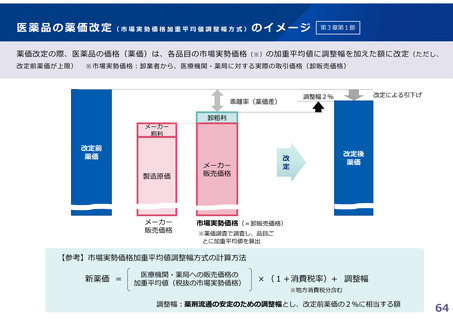
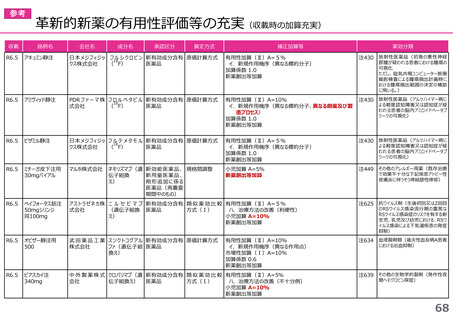
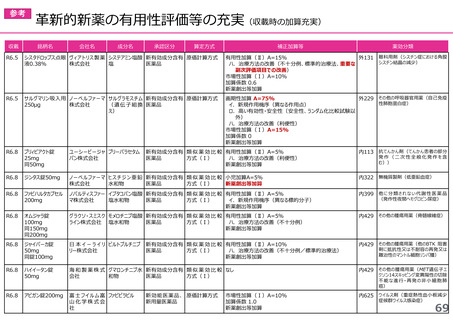
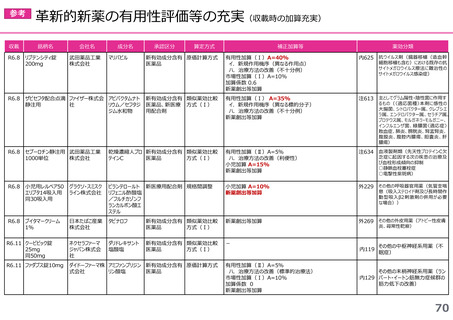
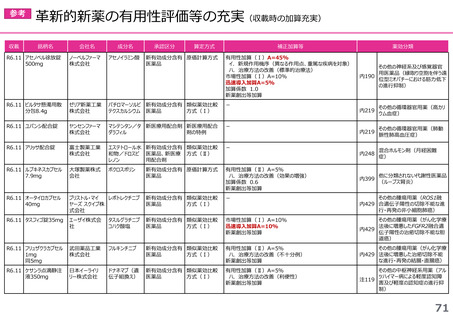
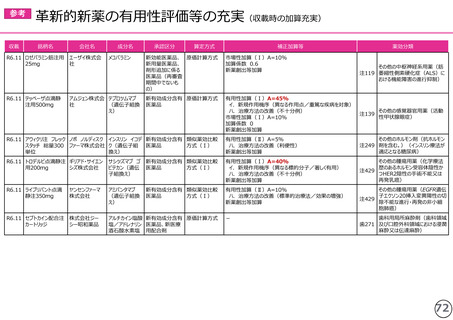
(1)新薬収載時の評価
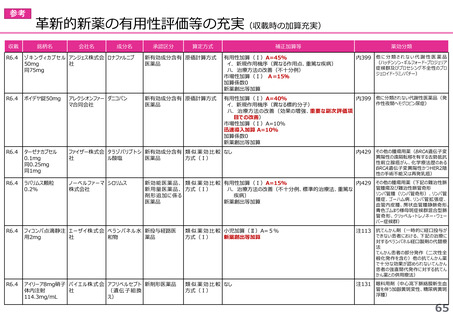
迅速導入加算の適用品目
○ボイデヤ錠50mg
成分名:ダニコパン
効能・効果:発作性夜間ヘモグロビン尿症
迅速導入加算A=10%
理由:本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申請は欧米において最も早い承認申請から6か
月以内及び承認は欧米より早いことから、加算の要件を満たす。国際共同治験における日本人症例数が比較的多いことを踏まえ、加
算率は10%が妥当である。
○アジンマ静注用1500
成分名:アパダムターゼ アルファ(遺伝子組換え)・シナキサダムターゼ アルファ(遺伝子組換え)混合物
効能・効果:先天性血栓性血小板減少性紫斑病
迅速導入加算A=5%
理由:本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申請及び承認は欧米において最も早い承認申請
及び承認から6か月以内であることから、加算の要件を満たす。
○アセノベル徐放錠500mg
成分名:アセノイラミン酸
効能・効果:縁取り空胞を伴う遠位型ミオパチーにおける筋力低下の進行抑制
迅速導入加算A=5%
理由:本剤は日本以外の国と同時に臨床試験を実施して開発され、優先審査の対象であり、かつ欧米では承認申請及び承認されていない品
目であることから、加算の要件を満たす。
○タスフィゴ錠35mg
成分名:タスルグラチニブコハク酸塩
効能・効果:がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌
迅速導入加算A=10%
理由:本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申請及び承認は欧米より早いことから、加算の
要件を満たす。国際共同治験における日本人症例数が比較的多いことを踏まえ、加算率は10%が妥当である。
※ 迅速導入加算以外の加算については省略
20
20
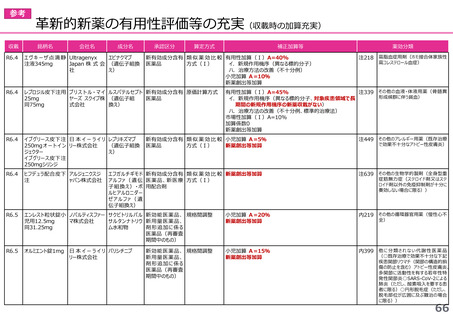
迅速導入加算の適用品目
○ボイデヤ錠50mg
成分名:ダニコパン
効能・効果:発作性夜間ヘモグロビン尿症
迅速導入加算A=10%
理由:本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申請は欧米において最も早い承認申請から6か
月以内及び承認は欧米より早いことから、加算の要件を満たす。国際共同治験における日本人症例数が比較的多いことを踏まえ、加
算率は10%が妥当である。
○アジンマ静注用1500
成分名:アパダムターゼ アルファ(遺伝子組換え)・シナキサダムターゼ アルファ(遺伝子組換え)混合物
効能・効果:先天性血栓性血小板減少性紫斑病
迅速導入加算A=5%
理由:本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申請及び承認は欧米において最も早い承認申請
及び承認から6か月以内であることから、加算の要件を満たす。
○アセノベル徐放錠500mg
成分名:アセノイラミン酸
効能・効果:縁取り空胞を伴う遠位型ミオパチーにおける筋力低下の進行抑制
迅速導入加算A=5%
理由:本剤は日本以外の国と同時に臨床試験を実施して開発され、優先審査の対象であり、かつ欧米では承認申請及び承認されていない品
目であることから、加算の要件を満たす。
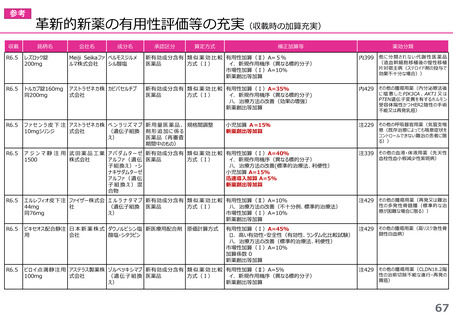
○タスフィゴ錠35mg
成分名:タスルグラチニブコハク酸塩
効能・効果:がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌
迅速導入加算A=10%
理由:本剤は国際共同治験により開発され、優先審査の対象であり、かつ本邦における承認申請及び承認は欧米より早いことから、加算の
要件を満たす。国際共同治験における日本人症例数が比較的多いことを踏まえ、加算率は10%が妥当である。
※ 迅速導入加算以外の加算については省略
20
20