よむ、つかう、まなぶ。
資料1.緊急時の薬事承認の在り方. (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22502.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第2回 12/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
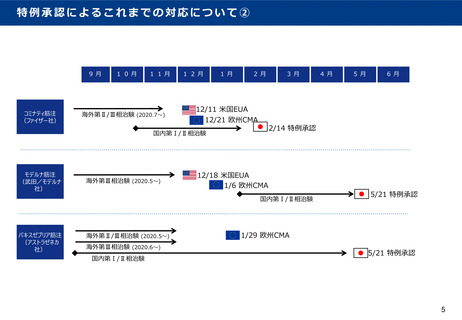
その他:新たな制度における各種特例について
○ 特例承認と概ね同内容の各種特例を措置してはどうか。
項目
措置の内容
承認時の業許可
・製造販売業許可
・製造業許可
承認時においては、
①申請者が製造販売業許可を有していることは必要としない
②製造所が製造業許可を有していることは必要としない
申請時の添付資料
①臨床試験等の試験成績、製造方法、規格及び試験方法に関する資料のみ提出必須
②その他の資料(薬理作用に関する資料等)
は、提出を猶予
GMP適合性
GMP調査
GCP等適合性
GCP等調査
国家検定の免除
製造所のGMP適合性
審査の迅速化の観点から承認時における製造所のGMP適合性を必要としない
GMP調査
一定の時間を要することから、GMP調査を免除。必要な場合、事後的に調査を実施することが可能
申請書類のGCP等の信頼性基準の遵守
申請書類の信頼性は緊急時においても必要
GCP等調査
一定の時間を要することから、信頼性適合調査、GCP調査を免除。必要な場合、事後的に調査を実施
することが可能
国家検定を免除
容器等への記載の特例
法定表示の記載について、添付文書への記載でも可能
注意事項等情報の特例
・容器等に、緊急時の薬事承認である旨を記載
・注意事項等情報を入手する符号の記載について、添付文書でも可能
販売、製造等の禁止
にかかる特例
国内の製造基準(日本薬局方の基準等)に適合しないものは販売、製造等が禁止されるという規定か
ら除外
19
○ 特例承認と概ね同内容の各種特例を措置してはどうか。
項目
措置の内容
承認時の業許可
・製造販売業許可
・製造業許可
承認時においては、
①申請者が製造販売業許可を有していることは必要としない
②製造所が製造業許可を有していることは必要としない
申請時の添付資料
①臨床試験等の試験成績、製造方法、規格及び試験方法に関する資料のみ提出必須
②その他の資料(薬理作用に関する資料等)
は、提出を猶予
GMP適合性
GMP調査
GCP等適合性
GCP等調査
国家検定の免除
製造所のGMP適合性
審査の迅速化の観点から承認時における製造所のGMP適合性を必要としない
GMP調査
一定の時間を要することから、GMP調査を免除。必要な場合、事後的に調査を実施することが可能
申請書類のGCP等の信頼性基準の遵守
申請書類の信頼性は緊急時においても必要
GCP等調査
一定の時間を要することから、信頼性適合調査、GCP調査を免除。必要な場合、事後的に調査を実施
することが可能
国家検定を免除
容器等への記載の特例
法定表示の記載について、添付文書への記載でも可能
注意事項等情報の特例
・容器等に、緊急時の薬事承認である旨を記載
・注意事項等情報を入手する符号の記載について、添付文書でも可能
販売、製造等の禁止
にかかる特例
国内の製造基準(日本薬局方の基準等)に適合しないものは販売、製造等が禁止されるという規定か
ら除外
19