よむ、つかう、まなぶ。
資料1.緊急時の薬事承認の在り方. (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22502.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第2回 12/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第1回制度部会(2021年11月18日)でいただいた主なご意見
<これまでの対応の振り返り等>
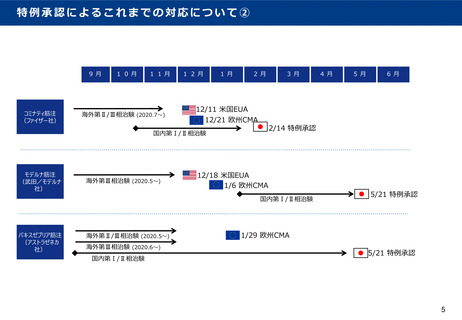
○ これまでの特例承認による緊急時の対応についての分析、検証を行ってほしい。
○ 制度の如何に問わず、承認には臨床試験で一定のデータが必要である。臨床試験の体制整備もあわせて進めてほし
い。
○ 企業との契約で薬価については非公開になっているが、何らかのタイミングで公開する予定はあるか。
先例があればどのような手順で明らかになるのか伺いたい。
<発動要件の明確化>
○ 制度の発動要件である「緊急時」とは何か明確化すべき。発動要件の認定の手続についても明確化する必要がある。
<運用の基準>
○ 緊急時の薬事承認に当たっては、海外と同等レベルのデータは必要。特に安全性は十分に確認することが必要であ
る。
<条件・期限。期限内での改めての有効性等の確認>
○ 条件や期限については緊急時の制度であることに鑑み、詳細な検討が必要である。
○ 期限内に改めて有効性等を確認するプロセスにおいて、リアルワールドデータの活用について検討する必要がある。
<市販後の対応>
○ 損害賠償の免責についてEUの各国の対応も教えてほしい。
○ 市販後の対応については、例えば、全例調査の実施や審議会の開催の頻度の増加など丁寧に対応する必要がある。
○ 民間が対応する市販後の安全対応や健康被害の救済については、国が免責や救済を含め、サポートする必要がある。
<その他>
○ 複数の承認制度があるが、一般の方に広く理解されているわけではない。この薬はどの制度で承認された薬なのか
分かりやすく一般の方が区別できるようにしてほしい。
○ 緊急時の薬事承認について、医療機器にも適用の場面は想定される。
2
<これまでの対応の振り返り等>
○ これまでの特例承認による緊急時の対応についての分析、検証を行ってほしい。
○ 制度の如何に問わず、承認には臨床試験で一定のデータが必要である。臨床試験の体制整備もあわせて進めてほし
い。
○ 企業との契約で薬価については非公開になっているが、何らかのタイミングで公開する予定はあるか。
先例があればどのような手順で明らかになるのか伺いたい。
<発動要件の明確化>
○ 制度の発動要件である「緊急時」とは何か明確化すべき。発動要件の認定の手続についても明確化する必要がある。
<運用の基準>
○ 緊急時の薬事承認に当たっては、海外と同等レベルのデータは必要。特に安全性は十分に確認することが必要であ
る。
<条件・期限。期限内での改めての有効性等の確認>
○ 条件や期限については緊急時の制度であることに鑑み、詳細な検討が必要である。
○ 期限内に改めて有効性等を確認するプロセスにおいて、リアルワールドデータの活用について検討する必要がある。
<市販後の対応>
○ 損害賠償の免責についてEUの各国の対応も教えてほしい。
○ 市販後の対応については、例えば、全例調査の実施や審議会の開催の頻度の増加など丁寧に対応する必要がある。
○ 民間が対応する市販後の安全対応や健康被害の救済については、国が免責や救済を含め、サポートする必要がある。
<その他>
○ 複数の承認制度があるが、一般の方に広く理解されているわけではない。この薬はどの制度で承認された薬なのか
分かりやすく一般の方が区別できるようにしてほしい。
○ 緊急時の薬事承認について、医療機器にも適用の場面は想定される。
2