よむ、つかう、まなぶ。
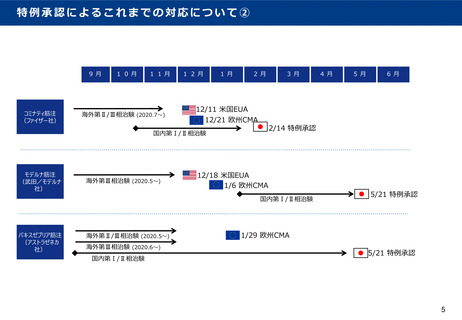
資料1.緊急時の薬事承認の在り方. (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22502.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第2回 12/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
その他:承認に当たってのGMP調査等について
○
特例承認と同様に、申請品目を製造する製造所の品目毎のGMP適合性を承認要件としないこととしてはどう
か。また、GMP調査の実施を免除することとしてはどうか。
通常の承認の場合
○ 通常の承認申請に当たっては、申請品目の品質等を確認するため、製造所の品目毎のGMP適合性を承認の要件とするとと
もに、GMP調査を実施している。
申請品目を製造する製造所の品目毎のGMP適合性について
○ GMP適合性に関しては、実際の製造時には、製造所が適切な構造設備を備え、製造管理に係る適切な体制に
基づき製造許可を有していることを前提として、品目の承認に際しては、医薬品の製造方法や規格・試験方法
の最終的な妥当性等について申請内容及び添付資料に基づき審査を行い、品質面で問題ないことを確認するこ
とから、品目毎のGMP適合性を承認における義務的要件とせずとも、最低限の品質の担保は可能。
○ 審査の迅速化の観点から、製造所の品目毎のGMP適合性を承認の要件としないこととしてはどうか。
GMP調査について
○ また、GMP調査は、製造所側での実地調査の受け入れ態勢の確保などを含め一定の期間を要するものであり、
迅速に行うこととした場合であっても、少なくとも1か月程度の期間を要する
(特例承認における実績に基づく。 PMDAの標準事務処理期間では半年程度)。
○ したがって、製造所の品目毎のGMP適合性を要件としないことに加え、事前のGMP調査を免除することとし
てはどうか。
制度の運用について
○ 実際の承認審査においては、モダリティ等に応じ必要なものは、実施可能な場合には事前のGMP調査を行う
とともに、GMP調査を実施しなかった場合でも可能な限り事後的に確認を行うことができるよう法令上措置し
てはどうか。
27
○
特例承認と同様に、申請品目を製造する製造所の品目毎のGMP適合性を承認要件としないこととしてはどう
か。また、GMP調査の実施を免除することとしてはどうか。
通常の承認の場合
○ 通常の承認申請に当たっては、申請品目の品質等を確認するため、製造所の品目毎のGMP適合性を承認の要件とするとと
もに、GMP調査を実施している。
申請品目を製造する製造所の品目毎のGMP適合性について
○ GMP適合性に関しては、実際の製造時には、製造所が適切な構造設備を備え、製造管理に係る適切な体制に
基づき製造許可を有していることを前提として、品目の承認に際しては、医薬品の製造方法や規格・試験方法
の最終的な妥当性等について申請内容及び添付資料に基づき審査を行い、品質面で問題ないことを確認するこ
とから、品目毎のGMP適合性を承認における義務的要件とせずとも、最低限の品質の担保は可能。
○ 審査の迅速化の観点から、製造所の品目毎のGMP適合性を承認の要件としないこととしてはどうか。
GMP調査について
○ また、GMP調査は、製造所側での実地調査の受け入れ態勢の確保などを含め一定の期間を要するものであり、
迅速に行うこととした場合であっても、少なくとも1か月程度の期間を要する
(特例承認における実績に基づく。 PMDAの標準事務処理期間では半年程度)。
○ したがって、製造所の品目毎のGMP適合性を要件としないことに加え、事前のGMP調査を免除することとし
てはどうか。
制度の運用について
○ 実際の承認審査においては、モダリティ等に応じ必要なものは、実施可能な場合には事前のGMP調査を行う
とともに、GMP調査を実施しなかった場合でも可能な限り事後的に確認を行うことができるよう法令上措置し
てはどうか。
27