よむ、つかう、まなぶ。
材ー1○ 令和6年度保険医療材料制度の見直しについて (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00041.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第127回 1/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
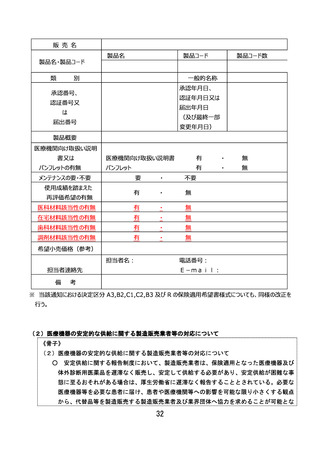
「体外診断用医薬品の保険適用に関する取扱いについて」
2 保険適用の手続
(2)区分E2(既存項目・変更あり)又は区分E3(新項目、改良項目)
エ 保険医療材料等専門組織の関与と中央社会保険医療協議会(以下「中医協」という。)による
承認
保険適用希望書の内容を審査の上、次の手順に従い、診療報酬における取扱いを決定する。な
お、決定区分E2(既存項目・変更あり)として希望のあったもののうち、その希望内容が既存検
査項目への検査方法の追加のみを行う等であり軽微な変更にとどまるものとして保険医療材料等専
門組織委員長が認めた場合においては、保険医療材料等専門組織への報告をもって決定案とする
ことができる。
① 区分E2(既存項目・変更あり)又は区分E3(新項目、改良項目)として希望のあった
体外診断用医薬品の診療報酬における取扱い等に関し、次の事項について保険医療材料等専
門組織の専門的見地からの検討を経て、決定案を策定する。なお、軽微な変更の場合を除き、
保険適用希望書を提出した製造販売業者であって、希望するものは、1回に限り決定案が決ま
る前に予め定められた時間の範囲内で保険医療材料等専門組織に出席して意見表明を行うこと
ができる。
この際、当該体外診断用医薬品の開発における臨床試験に関与した者が製造販売業者に同
行して意見を表明することができる。
1)~2) (略)
3)当該体外診断用医薬品を用いた新規測定項目の算定に当たって準用する既存の測定項
目選定の妥当性、両者の技術的相違点及び希少疾病等の検査に用いるものとして配慮が
必要な体外診断用医薬品の該当性(該当する場合は別紙7に定める算式に基づき技術
料の設定を行う。)(区分E3(新項目、改良項目)の場合)。
4 既存体外診断用医薬品を用いる測定項目の技術料の見直しに係る手続
(2)希少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品等を用いる技術に係る技術料の
見直しに係る手続
ア 希少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品に係る技術料の見直しの
対象について、以下の基準を設ける。
希少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品であって、年間算定回数
(当該技術料の診療報酬改定の前年度の年間算定回数をいう。以下同じ。)が保険適用時に
想定された予想年間算定回数を超えており、当該年間算定回数を予想年間検査回数として別紙
7に基づき算出した場合の技術料が現在の技術料を下回る場合に、見直しの対象とする。
なお、予想年間算定回数は、保険適用された時点における当該技術料のピーク時の推定適用患
者数を基に計算した年間算定回数とする。ただし、当該技術が、前回の診療報酬改定以前に、希
少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品に係る技術料の見直しの対
象となっている場合には、直近に当該再算定を行った時点における当該技術の年間販売額とする。
14
2 保険適用の手続
(2)区分E2(既存項目・変更あり)又は区分E3(新項目、改良項目)
エ 保険医療材料等専門組織の関与と中央社会保険医療協議会(以下「中医協」という。)による
承認
保険適用希望書の内容を審査の上、次の手順に従い、診療報酬における取扱いを決定する。な
お、決定区分E2(既存項目・変更あり)として希望のあったもののうち、その希望内容が既存検
査項目への検査方法の追加のみを行う等であり軽微な変更にとどまるものとして保険医療材料等専
門組織委員長が認めた場合においては、保険医療材料等専門組織への報告をもって決定案とする
ことができる。
① 区分E2(既存項目・変更あり)又は区分E3(新項目、改良項目)として希望のあった
体外診断用医薬品の診療報酬における取扱い等に関し、次の事項について保険医療材料等専
門組織の専門的見地からの検討を経て、決定案を策定する。なお、軽微な変更の場合を除き、
保険適用希望書を提出した製造販売業者であって、希望するものは、1回に限り決定案が決ま
る前に予め定められた時間の範囲内で保険医療材料等専門組織に出席して意見表明を行うこと
ができる。
この際、当該体外診断用医薬品の開発における臨床試験に関与した者が製造販売業者に同
行して意見を表明することができる。
1)~2) (略)
3)当該体外診断用医薬品を用いた新規測定項目の算定に当たって準用する既存の測定項
目選定の妥当性、両者の技術的相違点及び希少疾病等の検査に用いるものとして配慮が
必要な体外診断用医薬品の該当性(該当する場合は別紙7に定める算式に基づき技術
料の設定を行う。)(区分E3(新項目、改良項目)の場合)。
4 既存体外診断用医薬品を用いる測定項目の技術料の見直しに係る手続
(2)希少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品等を用いる技術に係る技術料の
見直しに係る手続
ア 希少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品に係る技術料の見直しの
対象について、以下の基準を設ける。
希少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品であって、年間算定回数
(当該技術料の診療報酬改定の前年度の年間算定回数をいう。以下同じ。)が保険適用時に
想定された予想年間算定回数を超えており、当該年間算定回数を予想年間検査回数として別紙
7に基づき算出した場合の技術料が現在の技術料を下回る場合に、見直しの対象とする。
なお、予想年間算定回数は、保険適用された時点における当該技術料のピーク時の推定適用患
者数を基に計算した年間算定回数とする。ただし、当該技術が、前回の診療報酬改定以前に、希
少疾病等の検査に用いるものとして配慮が必要な体外診断用医薬品に係る技術料の見直しの対
象となっている場合には、直近に当該再算定を行った時点における当該技術の年間販売額とする。
14