よむ、つかう、まなぶ。
材ー1○ 令和6年度保険医療材料制度の見直しについて (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00041.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第127回 1/17)《厚生労働省》 |
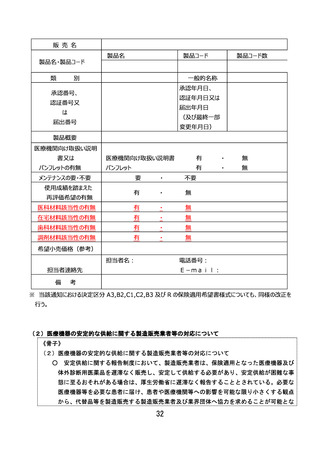
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
るよう制度を見直すとともに、報告に係る様式等について所要の見直しを行う。
【改正後】
「医療機器に係る保険適用希望書の提出方法等について」
8 医療機器の供給について
(1) 当該医療機器について、供給を継続する意思を有しているものの、安定供給が困難な事態に至るおそれがあ
る場合の取扱いについて
① 臨床現場への影響が大きい(又は大きい可能性がある)と判断した場合には、第一報として「医療
機 器 の 安 定 供 給 に 係 る 報 告 」 ( 様 式 10 - 2 ) を 遅 滞 な く 医 政 局 産 情 課 ( kikisupply@mhlw.go.jp)宛てに電子メールにて提出すること。第一報における「医療機器の安定供給
に係る報告」(様式 10-2)は、その時点で把握している情報を記載すれば足りることとし、空欄を許
容する。なお、本通知では、供給を継続する意思を有しているものの、安定供給が困難な事態に至るお
それ(製造販売業者が卸売業者又は医療機関等が必要とする量の製品を供給できなくなる可能性
がある状況をいう。)を「供給不安」といい、供給不安が生じた結果、一時的に当該製造販売業者、
卸売業者又は医療機関等における当該医療機器の在庫がない状況を「欠品」という。
供給不安や欠品として、具体的には以下のような例が想定される(なお、以下に掲げる例は、あく
までこれまでの事例等を踏まえた一例であり、報告の対象を網羅するものではない点に留意された
い。)。
・ 製造所の移転や、医薬品医療機器等法に基づく医療機器の承認、認証又は届出について他社への
承継を行う場合等、手続に時間を要する場合
・ 原材料等の入手が困難となった場合や、製造所に災害等の影響があった場合等、製造が困難な場
合
・ 感染症等により急増した医療機関等からの医療機器の需要に応じられなくなる場合
② 第一報後、臨床現場への影響や回復の見通しを評価し、追加報告として「医療機器の安定供給に
係る報告」(様式 10-2)を医政局産情課宛てに遅滞なく電子メールにて提出すること。追加報告
における「医療機器の安定供給に係る報告」(様式 10-2)は、第一報と様式は同一であるが、原
則全ての項目を埋めて提出する必要がある。
③ ①の時点では臨床現場への影響が大きい(又は大きい可能性がある)とは判断せず、第一報を行
わなかった場合においても、臨床現場への影響や回復の見通しを評価すること。評価の結果、臨床現
場への影響が大きいと判明した場合(又は大きい可能性があると判明した場合を含む。)には、「医療
機器の安定供給に係る報告」(様式 10-2)を医政局産情課宛てに遅滞なく電子メールにて提出
すること(本項における提出も、本通知の都合上、④以降においては「追加報告」という。)。この場合
における「医療機器の安定供給に係る報告」(様式 10-2)は、原則全ての項目を埋めて提出する
必要がある。
④ 追加報告後、医政局産情課より追加対応が必要と判断され、対応の検討依頼がなされた場合には、
「医療機器・体外診断用医薬品の安定供給に支障が生じた場合の対応について」(令和●年●月
●日医政産情企発●第●号)(以下「支障時対応通知」という。)に記載の手順に沿って、代替品
を取り扱う製造販売業者(以下「代替品製造販売業者」という。)と安定供給に向けて調整を行うこ
とや、医療機関等に対してはウェブサイトやカスタマーレター等を通じて、関係学会等に対しては面談等
33
【改正後】
「医療機器に係る保険適用希望書の提出方法等について」
8 医療機器の供給について
(1) 当該医療機器について、供給を継続する意思を有しているものの、安定供給が困難な事態に至るおそれがあ
る場合の取扱いについて
① 臨床現場への影響が大きい(又は大きい可能性がある)と判断した場合には、第一報として「医療
機 器 の 安 定 供 給 に 係 る 報 告 」 ( 様 式 10 - 2 ) を 遅 滞 な く 医 政 局 産 情 課 ( kikisupply@mhlw.go.jp)宛てに電子メールにて提出すること。第一報における「医療機器の安定供給
に係る報告」(様式 10-2)は、その時点で把握している情報を記載すれば足りることとし、空欄を許
容する。なお、本通知では、供給を継続する意思を有しているものの、安定供給が困難な事態に至るお
それ(製造販売業者が卸売業者又は医療機関等が必要とする量の製品を供給できなくなる可能性
がある状況をいう。)を「供給不安」といい、供給不安が生じた結果、一時的に当該製造販売業者、
卸売業者又は医療機関等における当該医療機器の在庫がない状況を「欠品」という。
供給不安や欠品として、具体的には以下のような例が想定される(なお、以下に掲げる例は、あく
までこれまでの事例等を踏まえた一例であり、報告の対象を網羅するものではない点に留意された
い。)。
・ 製造所の移転や、医薬品医療機器等法に基づく医療機器の承認、認証又は届出について他社への
承継を行う場合等、手続に時間を要する場合
・ 原材料等の入手が困難となった場合や、製造所に災害等の影響があった場合等、製造が困難な場
合
・ 感染症等により急増した医療機関等からの医療機器の需要に応じられなくなる場合
② 第一報後、臨床現場への影響や回復の見通しを評価し、追加報告として「医療機器の安定供給に
係る報告」(様式 10-2)を医政局産情課宛てに遅滞なく電子メールにて提出すること。追加報告
における「医療機器の安定供給に係る報告」(様式 10-2)は、第一報と様式は同一であるが、原
則全ての項目を埋めて提出する必要がある。
③ ①の時点では臨床現場への影響が大きい(又は大きい可能性がある)とは判断せず、第一報を行
わなかった場合においても、臨床現場への影響や回復の見通しを評価すること。評価の結果、臨床現
場への影響が大きいと判明した場合(又は大きい可能性があると判明した場合を含む。)には、「医療
機器の安定供給に係る報告」(様式 10-2)を医政局産情課宛てに遅滞なく電子メールにて提出
すること(本項における提出も、本通知の都合上、④以降においては「追加報告」という。)。この場合
における「医療機器の安定供給に係る報告」(様式 10-2)は、原則全ての項目を埋めて提出する
必要がある。
④ 追加報告後、医政局産情課より追加対応が必要と判断され、対応の検討依頼がなされた場合には、
「医療機器・体外診断用医薬品の安定供給に支障が生じた場合の対応について」(令和●年●月
●日医政産情企発●第●号)(以下「支障時対応通知」という。)に記載の手順に沿って、代替品
を取り扱う製造販売業者(以下「代替品製造販売業者」という。)と安定供給に向けて調整を行うこ
とや、医療機関等に対してはウェブサイトやカスタマーレター等を通じて、関係学会等に対しては面談等
33