よむ、つかう、まなぶ。
材ー1○ 令和6年度保険医療材料制度の見直しについて (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00041.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第127回 1/17)《厚生労働省》 |
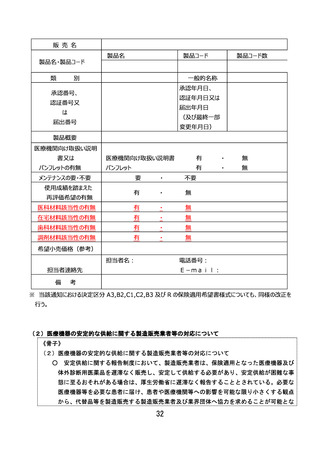
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2 保険適用希望書の提出方法
(1) 区分E1(既存項目)(チャレンジ申請を希望しないものに限る。)の保険適用希望書及び添付書
類は、電子媒体を医政局産情課(kiki-kibousyo@mhlw.go.jp)宛てに電子メールにて、又は電磁的
記録媒体(フロッピーディスク及び USB メモリは不可)に保存して提出するものとする。
(2)区分E1 (既存項目)(チャレンジ申請を希望するものに限る。)、区分E2(既存項目・変更あり)
又はE3(新項目、改良項目)の保険適用希望書及び添付書類等は、電子媒体を医政局産情課
(kikihoken@mhlw.go.jp)宛てに電子メールにて、又は電磁的記録媒体(フロッピーディスク及び USB
メモリは不可)に保存して提出するものとする。
(3)保険適用希望書には、区分に応じ以下の書類(様式1~7)を添付するものとする。
ア 区分E1(既存項目)については、保険適用希望書に以下の資料を次の順に添付すること。ただ
し、推定適用患者数が既存方法から変更がない場合は、様式2-2の添付は必要ないものとする。
なお、収載後にチャレンジ申請を希望する場合については⑥の記載に従い、様式6及び関連資料を
添付すること。
① 様式 1~4より必要に応じ選択
② 注意事項等情報
③ 薬事承認書及び承認申請書の写し、又は薬事認証書及び認証書申請書の写し
④ 薬事承認申請書添付資料の写し、又は認証申請書添付資料の写し
⑤ 文献一覧及び文献
⑥ 収載後にチャレンジ申請を希望する場合は、様式6に当該体外診断用医薬品についてチャレン
ジ申請を行うことが妥当な根拠、データの収集及び評価の計画を記載し、その関連資料を添付す
ること。
※ 当該通知における決定区分 E2 及び E3 を希望する体外診断用医薬品の保険適用希望書の提出方法に
ついても、同様の改正を行う。
6 収載後にチャレンジ申請を行うことの妥当性が認められた体外診断用医薬品の定期報告
収載後にチャレンジ申請を行うことの妥当性が認められた体外診断用医薬品であって、定期報告が必要と
されたものについては、権利付与後のデータ集積状況や臨床試験等の進捗を「収載後のチャレンジ申請に係
る定期報告」(様式 10)及び参考資料を別途定められた期限までに提出すること。なお、収載後のチャレン
ジ申請の希望を取り下げる場合にあっては、「収載後のチャレンジ申請に係る希望取下げ書」(様式 11)に
より、理由及び収載からチャレンジ申請の希望の取下げまでのデータ集積状況(提出時点までの臨床試験成
績を含む。)を提出すること。
7
(1) 区分E1(既存項目)(チャレンジ申請を希望しないものに限る。)の保険適用希望書及び添付書
類は、電子媒体を医政局産情課(kiki-kibousyo@mhlw.go.jp)宛てに電子メールにて、又は電磁的
記録媒体(フロッピーディスク及び USB メモリは不可)に保存して提出するものとする。
(2)区分E1 (既存項目)(チャレンジ申請を希望するものに限る。)、区分E2(既存項目・変更あり)
又はE3(新項目、改良項目)の保険適用希望書及び添付書類等は、電子媒体を医政局産情課
(kikihoken@mhlw.go.jp)宛てに電子メールにて、又は電磁的記録媒体(フロッピーディスク及び USB
メモリは不可)に保存して提出するものとする。
(3)保険適用希望書には、区分に応じ以下の書類(様式1~7)を添付するものとする。
ア 区分E1(既存項目)については、保険適用希望書に以下の資料を次の順に添付すること。ただ
し、推定適用患者数が既存方法から変更がない場合は、様式2-2の添付は必要ないものとする。
なお、収載後にチャレンジ申請を希望する場合については⑥の記載に従い、様式6及び関連資料を
添付すること。
① 様式 1~4より必要に応じ選択
② 注意事項等情報
③ 薬事承認書及び承認申請書の写し、又は薬事認証書及び認証書申請書の写し
④ 薬事承認申請書添付資料の写し、又は認証申請書添付資料の写し
⑤ 文献一覧及び文献
⑥ 収載後にチャレンジ申請を希望する場合は、様式6に当該体外診断用医薬品についてチャレン
ジ申請を行うことが妥当な根拠、データの収集及び評価の計画を記載し、その関連資料を添付す
ること。
※ 当該通知における決定区分 E2 及び E3 を希望する体外診断用医薬品の保険適用希望書の提出方法に
ついても、同様の改正を行う。
6 収載後にチャレンジ申請を行うことの妥当性が認められた体外診断用医薬品の定期報告
収載後にチャレンジ申請を行うことの妥当性が認められた体外診断用医薬品であって、定期報告が必要と
されたものについては、権利付与後のデータ集積状況や臨床試験等の進捗を「収載後のチャレンジ申請に係
る定期報告」(様式 10)及び参考資料を別途定められた期限までに提出すること。なお、収載後のチャレン
ジ申請の希望を取り下げる場合にあっては、「収載後のチャレンジ申請に係る希望取下げ書」(様式 11)に
より、理由及び収載からチャレンジ申請の希望の取下げまでのデータ集積状況(提出時点までの臨床試験成
績を含む。)を提出すること。
7