よむ、つかう、まなぶ。
【参考資料3】 「希少疾病用医薬品等の指定に関する取扱いについて」の一部改正について(令和6年1月16日通知) (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
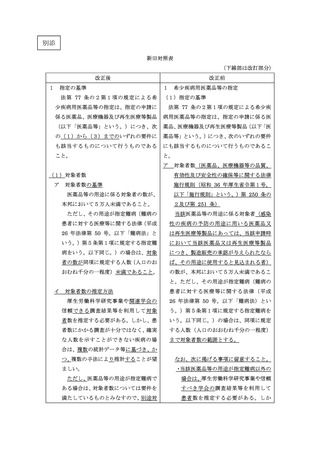
て同じ。)がないこと。
② 既承認薬等がある場合であって、いずれの既承認薬による治療を行
った場合でも予後不良など、当該既承認薬等のみでは治療法・予防
法として十分ではなく複数の選択肢が臨床的に必要とされている
こと(医療環境・投与環境から既承認薬の投与が困難である患者が
一定数存在すると考えられる場合を含む。)。例えば、新規作用機序
であって非臨床試験の結果等から効果が期待できること、医療環
境・投与環境から既承認薬の投与が困難である患者に対する投与が
可能となることが考えられることなど、医薬品等としての有用性が
一定程度期待されること。
③ 既承認薬等がある場合であって、臨床試験の結果等に基づき当該既
承認薬等と比較して高い有効性又は安全性が期待されること。
なお、高い有効性又は安全性が期待される場合としては、次のよう
な場合が該当しうると考えられるが、これらに限らず、薬剤、疾患
の特性等に応じ個別に判断すること。
⚫ 適切に設計された比較臨床試験において既承認薬と直接比較
した結果により有効性又は安全性における優越性が示されて
いること
⚫ 既承認薬と直接比較した臨床試験以外の臨床試験の結果等か
ら、既承認薬と比較して著しく高い有効性又は安全性が十分に
⚫
⚫
期待されること
国内又は国際的に認められている主要なガイドラインにおい
て、有効性又は安全性の観点から一定の科学的根拠に基づき既
承認薬と比較して高い優先度に位置づけられていること
添付文書上の注意喚起の程度が明らかに異なる(例えば、既承
認の適応での警告欄における記載が異なる)場合など、安全性
プロファイルが明らかに異なり既承認薬の投与が困難である
一定数の患者が治療可能になることから、安全性において優れ
ている蓋然性が高いこと
(3)開発の可能性
国内での開発を行うことのできる体制及び計画を有していること。
具体的には、承認申請に至るまでに実施する予定の臨床試験の概観が明
らかとなっていること。また、少なくとも初めて人に投与する臨床試験を実
施するために必要な非臨床試験については概ね完了していること。
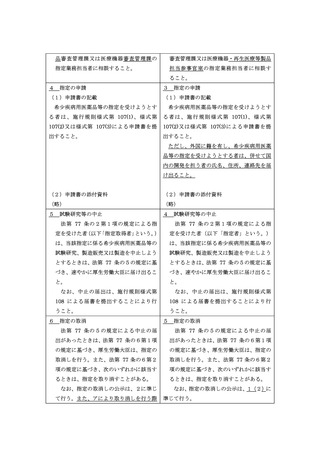
② 既承認薬等がある場合であって、いずれの既承認薬による治療を行
った場合でも予後不良など、当該既承認薬等のみでは治療法・予防
法として十分ではなく複数の選択肢が臨床的に必要とされている
こと(医療環境・投与環境から既承認薬の投与が困難である患者が
一定数存在すると考えられる場合を含む。)。例えば、新規作用機序
であって非臨床試験の結果等から効果が期待できること、医療環
境・投与環境から既承認薬の投与が困難である患者に対する投与が
可能となることが考えられることなど、医薬品等としての有用性が
一定程度期待されること。
③ 既承認薬等がある場合であって、臨床試験の結果等に基づき当該既
承認薬等と比較して高い有効性又は安全性が期待されること。
なお、高い有効性又は安全性が期待される場合としては、次のよう
な場合が該当しうると考えられるが、これらに限らず、薬剤、疾患
の特性等に応じ個別に判断すること。
⚫ 適切に設計された比較臨床試験において既承認薬と直接比較
した結果により有効性又は安全性における優越性が示されて
いること
⚫ 既承認薬と直接比較した臨床試験以外の臨床試験の結果等か
ら、既承認薬と比較して著しく高い有効性又は安全性が十分に
⚫
⚫
期待されること
国内又は国際的に認められている主要なガイドラインにおい
て、有効性又は安全性の観点から一定の科学的根拠に基づき既
承認薬と比較して高い優先度に位置づけられていること
添付文書上の注意喚起の程度が明らかに異なる(例えば、既承
認の適応での警告欄における記載が異なる)場合など、安全性
プロファイルが明らかに異なり既承認薬の投与が困難である
一定数の患者が治療可能になることから、安全性において優れ
ている蓋然性が高いこと
(3)開発の可能性
国内での開発を行うことのできる体制及び計画を有していること。
具体的には、承認申請に至るまでに実施する予定の臨床試験の概観が明
らかとなっていること。また、少なくとも初めて人に投与する臨床試験を実
施するために必要な非臨床試験については概ね完了していること。