よむ、つかう、まなぶ。
【参考資料3】 「希少疾病用医薬品等の指定に関する取扱いについて」の一部改正について(令和6年1月16日通知) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
は、事前に指定を受けた者の意見を聴くこ
ととする。
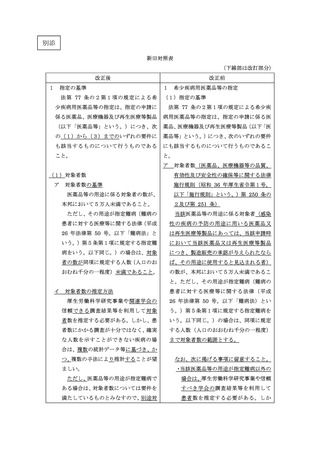
ア 1の要件を欠くと認められるとき。
ア
1(1)アの要件を欠くと認められる
とき。
イ
他の医薬品等が承認されたことなど
により、1(1)イの要件を欠くと認め
イ
指定申請書の虚偽記載等不正があっ
られるとき。
たと認められるとき。
ウ
ウ
正当な理由なく希少疾病用医薬品等
指定申請書の虚偽記載等不正があっ
たと認められるとき。
の試験研究又は製造販売が行われない
エ
とき。
正当な理由なく希少疾病用医薬品等
エ
の試験研究又は製造販売が行われない
指定を受けた者について法その他薬
とき。
事に関する法令で定めるもの又はこれ
オ
指定を受けた者について法その他薬
に基づく処分に違反する行為があった
事に関する法令で定めるもの又はこれ
とき。
に基づく処分に違反する行為があった
とき。
7 承継の取扱い
6
承継の取扱い
指定取得者から、他の者に本邦での開発
指定者から、他の者(以下「承継者」と
権を譲渡する場合、指定取得者は、5に従
いう。)に本邦での開発権を譲渡する場合、
って、試験研究等の中止の届出を行い、開
指定者は、4に従って、試験研究等の中止
発権を譲渡された者(以下「承継予定者」
の届出を行い、承継者は、3(1)及び(2)
という。)は、4(1)及び(2)のオの
のオの資料を提出すること。ただし、指定
資料を提出すること。ただし、指定取得者
者が当該指定を受けた時点から、変更が生
が指定を受けた時点から、資料の内容に変
じている場合には、変更部分について、承
更が生じている場合には、当該変更部分に
継時点でも指定要件を充足することを示
ついて、承継時点でも指定要件を充足する
す資料も併せて提出すること。なお、承継
ことを示す資料も併せて提出すること。な
は別途発出する指定書を以て認めるもの
お、承継は別途発出する指定書を以て認め
とする。
るものとする。
なお、承継を検討している指定者は事前
なお、承継を検討している指定取得者は
に2に記載する指定業務担当者へ相談す
事前に3に記載する指定業務担当者へ相
ること。その際、承継に係る契約書の写し
談すること。その際、承継に係る契約書の
や承継の経緯等が把握できる資料等も提
写しや承継の経緯等が把握できる資料等
出すること。
も提出すること。
8 優先審査及び優先相談の取扱い
希少疾病用医薬品のうち、優先審査及び
(新規)
ととする。
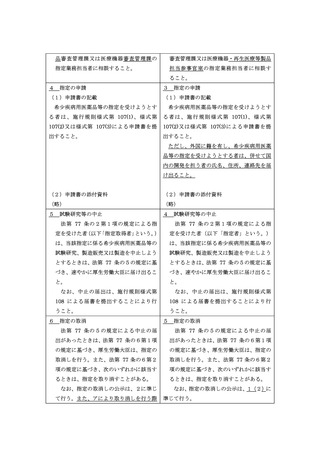
ア 1の要件を欠くと認められるとき。
ア
1(1)アの要件を欠くと認められる
とき。
イ
他の医薬品等が承認されたことなど
により、1(1)イの要件を欠くと認め
イ
指定申請書の虚偽記載等不正があっ
られるとき。
たと認められるとき。
ウ
ウ
正当な理由なく希少疾病用医薬品等
指定申請書の虚偽記載等不正があっ
たと認められるとき。
の試験研究又は製造販売が行われない
エ
とき。
正当な理由なく希少疾病用医薬品等
エ
の試験研究又は製造販売が行われない
指定を受けた者について法その他薬
とき。
事に関する法令で定めるもの又はこれ
オ
指定を受けた者について法その他薬
に基づく処分に違反する行為があった
事に関する法令で定めるもの又はこれ
とき。
に基づく処分に違反する行為があった
とき。
7 承継の取扱い
6
承継の取扱い
指定取得者から、他の者に本邦での開発
指定者から、他の者(以下「承継者」と
権を譲渡する場合、指定取得者は、5に従
いう。)に本邦での開発権を譲渡する場合、
って、試験研究等の中止の届出を行い、開
指定者は、4に従って、試験研究等の中止
発権を譲渡された者(以下「承継予定者」
の届出を行い、承継者は、3(1)及び(2)
という。)は、4(1)及び(2)のオの
のオの資料を提出すること。ただし、指定
資料を提出すること。ただし、指定取得者
者が当該指定を受けた時点から、変更が生
が指定を受けた時点から、資料の内容に変
じている場合には、変更部分について、承
更が生じている場合には、当該変更部分に
継時点でも指定要件を充足することを示
ついて、承継時点でも指定要件を充足する
す資料も併せて提出すること。なお、承継
ことを示す資料も併せて提出すること。な
は別途発出する指定書を以て認めるもの
お、承継は別途発出する指定書を以て認め
とする。
るものとする。
なお、承継を検討している指定者は事前
なお、承継を検討している指定取得者は
に2に記載する指定業務担当者へ相談す
事前に3に記載する指定業務担当者へ相
ること。その際、承継に係る契約書の写し
談すること。その際、承継に係る契約書の
や承継の経緯等が把握できる資料等も提
写しや承継の経緯等が把握できる資料等
出すること。
も提出すること。
8 優先審査及び優先相談の取扱い
希少疾病用医薬品のうち、優先審査及び
(新規)