よむ、つかう、まなぶ。
【参考資料3】 「希少疾病用医薬品等の指定に関する取扱いについて」の一部改正について(令和6年1月16日通知) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37787.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第8回 2/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添
新旧対照表
(下線部は改訂部分)
改正後
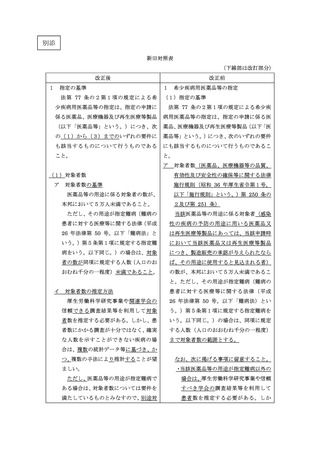
1 指定の基準
法第 77 条の2第1項の規定による希
改正前
1
希少疾病用医薬品等の指定
(1)指定の基準
少疾病用医薬品等の指定は、指定の申請に
法第 77 条の2第1項の規定による希少疾
係る医薬品、医療機器及び再生医療等製品
病用医薬品等の指定は、指定の申請に係る医
(以下「医薬品等」という。)につき、次
薬品、医療機器及び再生医療等製品(以下「医
の(1)から(3)までのいずれの要件に
薬品等」という。)につき、次のいずれの要件
も該当するものについて行うものである
にも該当するものについて行うものであるこ
こと。
と。
ア
(1)対象者数
ア 対象者数の基準
医薬品等の用途に係る対象者の数が、
本邦において5万人未満であること。
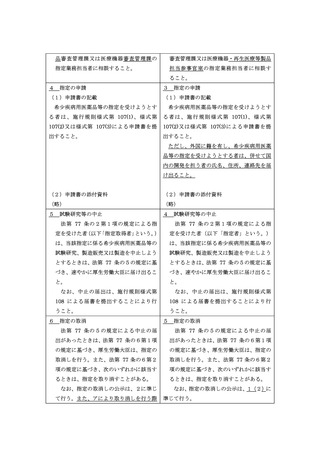
対象者数(医薬品、医療機器等の品質、
有効性及び安全性の確保等に関する法律
施行規則(昭和 36 年厚生省令第1号。
以下「施行規則」という。)第 250 条の
2及び第 251 条)
ただし、その用途が指定難病(難病の
当該医薬品等の用途に係る対象者(感染
患者に対する医療等に関する法律(平成
性の疾病の予防の用途に用いる医薬品又
26 年法律第 50 号。以下「難病法」と
は再生医療等製品にあっては、当該申請時
いう。)第5条第1項に規定する指定難
において当該医薬品又は再生医療等製品
病をいう。以下同じ。)の場合は、対象
につき、製造販売の承認が与えられたなら
者の数が同項に規定する人数(人口のお
ば、その用途に使用すると見込まれる者)
おむね千分の一程度)未満であること。
の数が、本邦において5万人未満であるこ
と。ただし、その用途が指定難病(難病の
イ 対象者数の推定方法
患者に対する医療等に関する法律(平成
厚生労働科学研究事業や関連学会の
26 年法律第 50 号。以下「難病法)とい
信頼できる調査結果等を利用して対象
う。)第5条第1項に規定する指定難病を
者数を推定する必要がある。しかし、患
いう。以下同じ。)の場合は、同項に規定
者数にかかる調査が十分ではなく、確実
する人数(人口のおおむね千分の一程度)
な人数を示すことができない疾病の場
まで対象者数の範囲とする。
合は、複数の統計データ等に基づき、か
つ、複数の手法により推計することが望
なお、次に掲げる事項に留意すること。
ましい。
・当該医薬品等の用途が指定難病以外の
ただし、医薬品等の用途が指定難病で
場合は、厚生労働科学研究事業や信頼
ある場合は、対象者数については要件を
すべき学会の調査結果等を利用して
満たしているものとみなすので、別途対
患者数を推定する必要がある。しか
新旧対照表
(下線部は改訂部分)
改正後
1 指定の基準
法第 77 条の2第1項の規定による希
改正前
1
希少疾病用医薬品等の指定
(1)指定の基準
少疾病用医薬品等の指定は、指定の申請に
法第 77 条の2第1項の規定による希少疾
係る医薬品、医療機器及び再生医療等製品
病用医薬品等の指定は、指定の申請に係る医
(以下「医薬品等」という。)につき、次
薬品、医療機器及び再生医療等製品(以下「医
の(1)から(3)までのいずれの要件に
薬品等」という。)につき、次のいずれの要件
も該当するものについて行うものである
にも該当するものについて行うものであるこ
こと。
と。
ア
(1)対象者数
ア 対象者数の基準
医薬品等の用途に係る対象者の数が、
本邦において5万人未満であること。
対象者数(医薬品、医療機器等の品質、
有効性及び安全性の確保等に関する法律
施行規則(昭和 36 年厚生省令第1号。
以下「施行規則」という。)第 250 条の
2及び第 251 条)
ただし、その用途が指定難病(難病の
当該医薬品等の用途に係る対象者(感染
患者に対する医療等に関する法律(平成
性の疾病の予防の用途に用いる医薬品又
26 年法律第 50 号。以下「難病法」と
は再生医療等製品にあっては、当該申請時
いう。)第5条第1項に規定する指定難
において当該医薬品又は再生医療等製品
病をいう。以下同じ。)の場合は、対象
につき、製造販売の承認が与えられたなら
者の数が同項に規定する人数(人口のお
ば、その用途に使用すると見込まれる者)
おむね千分の一程度)未満であること。
の数が、本邦において5万人未満であるこ
と。ただし、その用途が指定難病(難病の
イ 対象者数の推定方法
患者に対する医療等に関する法律(平成
厚生労働科学研究事業や関連学会の
26 年法律第 50 号。以下「難病法)とい
信頼できる調査結果等を利用して対象
う。)第5条第1項に規定する指定難病を
者数を推定する必要がある。しかし、患
いう。以下同じ。)の場合は、同項に規定
者数にかかる調査が十分ではなく、確実
する人数(人口のおおむね千分の一程度)
な人数を示すことができない疾病の場
まで対象者数の範囲とする。
合は、複数の統計データ等に基づき、か
つ、複数の手法により推計することが望
なお、次に掲げる事項に留意すること。
ましい。
・当該医薬品等の用途が指定難病以外の
ただし、医薬品等の用途が指定難病で
場合は、厚生労働科学研究事業や信頼
ある場合は、対象者数については要件を
すべき学会の調査結果等を利用して
満たしているものとみなすので、別途対
患者数を推定する必要がある。しか