よむ、つかう、まなぶ。
22 令和6年度診療報酬改定の概要 費用対効果評価制度 (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000196352_00012.html |
| 出典情報 | 令和6年度診療報酬改定説明資料等について(3/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
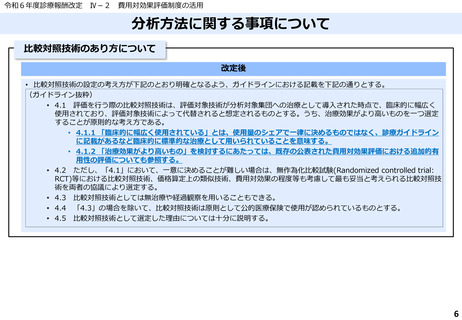
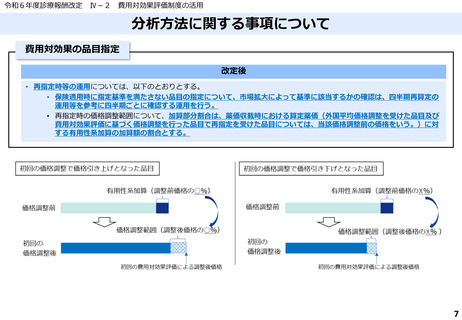
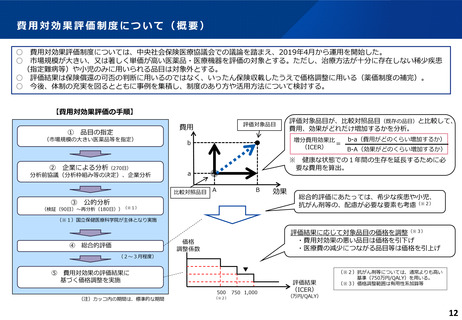
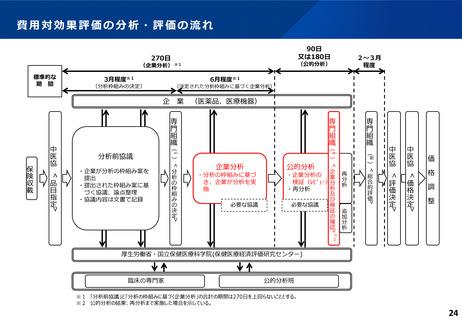
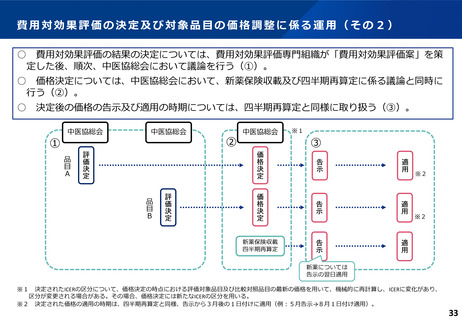
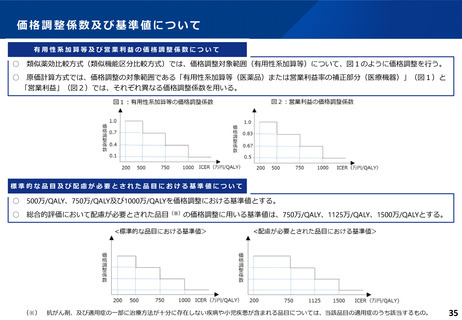
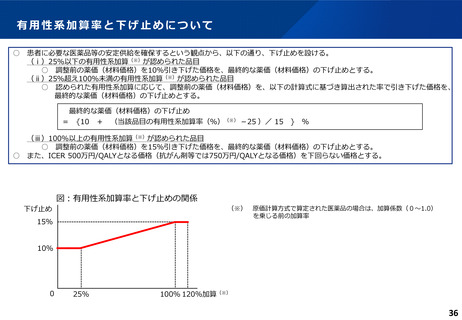
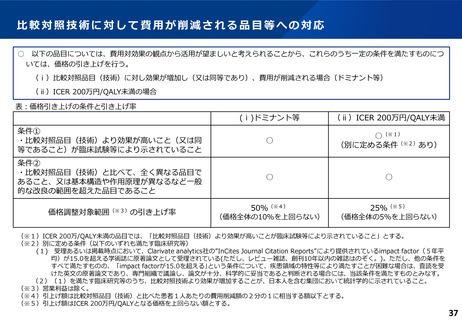
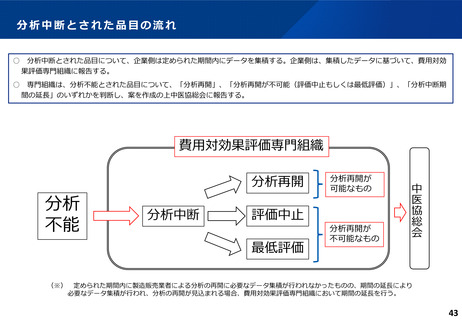
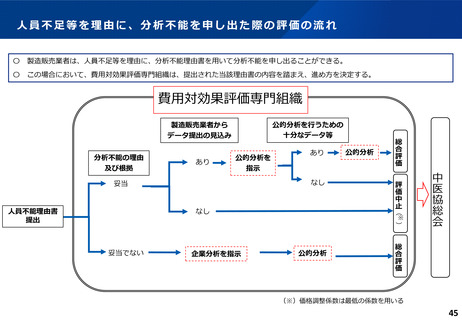
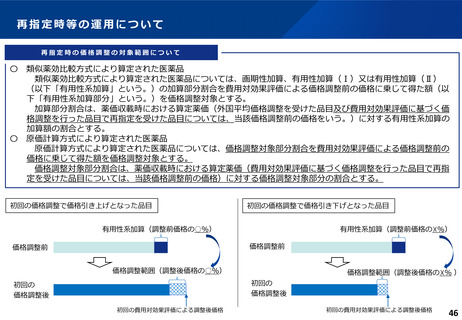
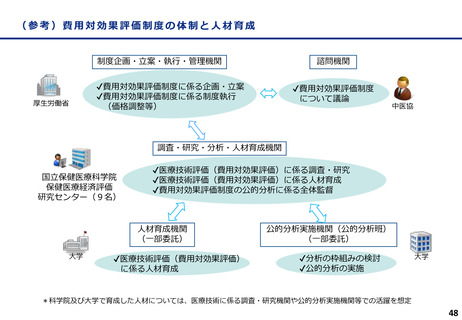
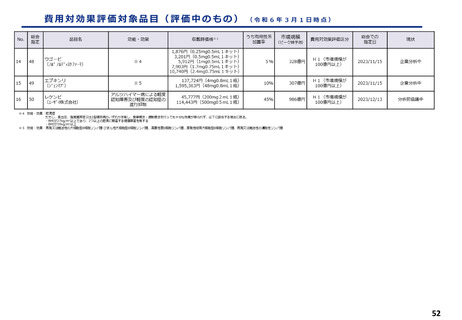
費用対効果評価の結果及び価格調整係数について
ICERの区分
別に定める条件
基本区分
総合的評価で配慮が必要とされたもの
ドミナント
(比較対照技術に対し効果が増加し、かつ費
用が削減されるものをいう。)
(同左)
比較対照技術に対し効果が同等であり、かつ
費用が削減されるもの
(同左)
200 万円/QALY 未満
(同左)
価格調整係数※3
β
γ
θ
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.25
1.25
1.0
それ以外のもの
1.0
1.0
1.0
※1
※2
200 万円/QALY 以上500 万円/QALY 未満
200 万円/QALY 以上750 万円/QALY 未満
1.0
1.0
1.0
500 万円/QALY 以上750 万円/QALY 未満
750 万円/QALY 以上1,125 万円/QALY 未満
0.7
0.7
0.83
750 万円/QALY 以上1,000 万円/QALY 未満
1,125 万円/QALY 以上1,500 万円/QALY 未満
0.4
0.4
0.67
1,000 万円/QALY 以上
1,500 万円/QALY 以上
0.1
0.1
0.5
比較対象技術に対し効果が同等であり、かつ
費用が増加するもの
(同左)
0.1
0.1
0.5
比較対象技術に対し効果が同等であり、かつ
費用が同等となるもの
(同左)
0.1
0.1
0.5
※1(一)対象品目の効果が比較対照技術に対し増加又は同等であることが、メタ解析及びシステマチックレビューを除く臨床試験により示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※2(一)対象品目に係るメタ解析及びシステマチックレビューを除く臨床研究が、次のいずれにも該当すること。
(ア)対象品目に係る新規の臨床研究に関する論文が、impact factor(Clarivate analytics社の“InCites Journal Citation Reports”により提供されているimpact factorをいう。)の平均値(当該論文の受理又は論文掲
載時から過去5年間の平均値)が15.0を超える学術誌に原著論文として受理されていること。ただし、他の条件をすべて満たすものの、「impact factorが15.0を超える」という条件について、疾患領域の特
性等により満たすことが困難な場合は、査読を受けた英文の原著論文であり、専門組織で議論し、論文が十分、科学的に妥当であると判断される場合には、当該条件を満たすものとみなす。
(イ)当該論文を受理した学術誌が、レビュー雑誌又は創刊10年以内の学術誌でないこと。
(ウ)当該臨床研究において、比較対照技術より効果が増加することが、日本人を含む集団において統計学的に示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※3(1)類似薬効比較方式等により算定された医薬品
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1-β)
(2)原価計算方式により算定された医薬品(開示率が低いものに限る。)
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1- γ)- 営業利益部分 × (1-θ)
(3)別途、価格引下げの下限、価格引上げの上限のルールあり。
(4)価格調整に当たって、分析期間を超過した場合には、事前に企業に対して遅れた理由を確認した上で、その理由が妥当性を欠く場合については、最も小さな価格調整係数を用いることとする。
39
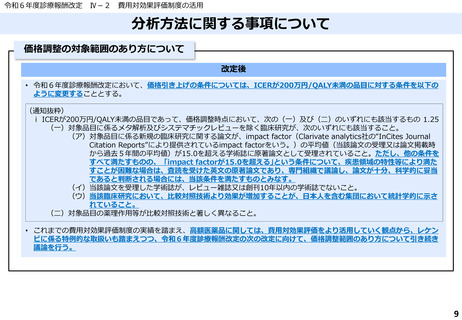
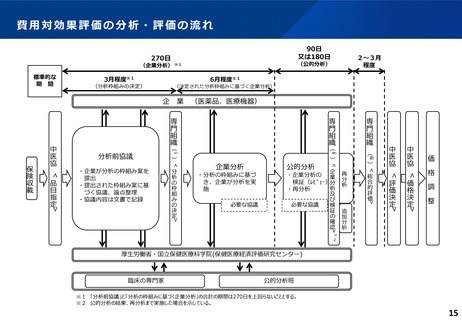
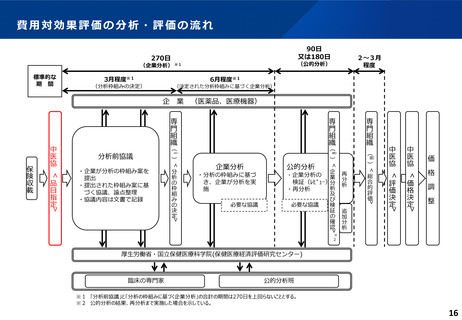
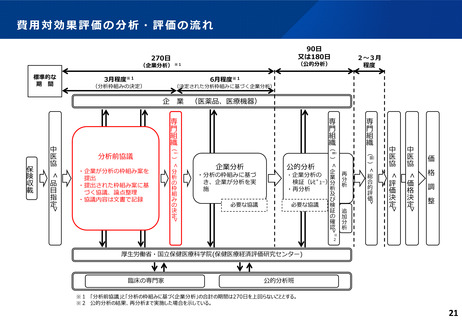
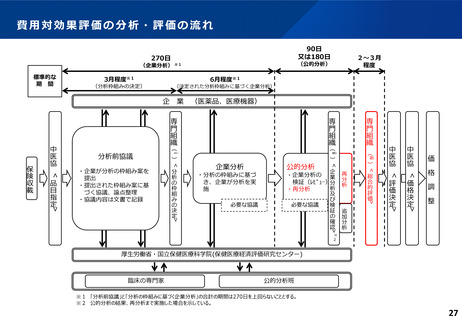
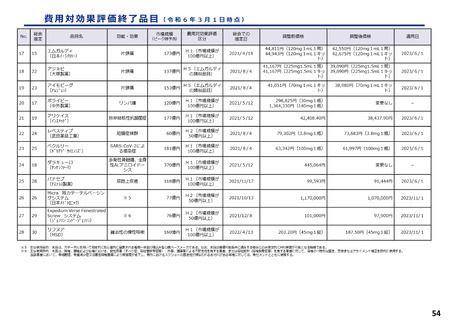
ICERの区分
別に定める条件
基本区分
総合的評価で配慮が必要とされたもの
ドミナント
(比較対照技術に対し効果が増加し、かつ費
用が削減されるものをいう。)
(同左)
比較対照技術に対し効果が同等であり、かつ
費用が削減されるもの
(同左)
200 万円/QALY 未満
(同左)
価格調整係数※3
β
γ
θ
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.5
1.5
1.0
それ以外のもの
1.0
1.0
1.0
いずれにも該当するもの
1.25
1.25
1.0
それ以外のもの
1.0
1.0
1.0
※1
※2
200 万円/QALY 以上500 万円/QALY 未満
200 万円/QALY 以上750 万円/QALY 未満
1.0
1.0
1.0
500 万円/QALY 以上750 万円/QALY 未満
750 万円/QALY 以上1,125 万円/QALY 未満
0.7
0.7
0.83
750 万円/QALY 以上1,000 万円/QALY 未満
1,125 万円/QALY 以上1,500 万円/QALY 未満
0.4
0.4
0.67
1,000 万円/QALY 以上
1,500 万円/QALY 以上
0.1
0.1
0.5
比較対象技術に対し効果が同等であり、かつ
費用が増加するもの
(同左)
0.1
0.1
0.5
比較対象技術に対し効果が同等であり、かつ
費用が同等となるもの
(同左)
0.1
0.1
0.5
※1(一)対象品目の効果が比較対照技術に対し増加又は同等であることが、メタ解析及びシステマチックレビューを除く臨床試験により示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※2(一)対象品目に係るメタ解析及びシステマチックレビューを除く臨床研究が、次のいずれにも該当すること。
(ア)対象品目に係る新規の臨床研究に関する論文が、impact factor(Clarivate analytics社の“InCites Journal Citation Reports”により提供されているimpact factorをいう。)の平均値(当該論文の受理又は論文掲
載時から過去5年間の平均値)が15.0を超える学術誌に原著論文として受理されていること。ただし、他の条件をすべて満たすものの、「impact factorが15.0を超える」という条件について、疾患領域の特
性等により満たすことが困難な場合は、査読を受けた英文の原著論文であり、専門組織で議論し、論文が十分、科学的に妥当であると判断される場合には、当該条件を満たすものとみなす。
(イ)当該論文を受理した学術誌が、レビュー雑誌又は創刊10年以内の学術誌でないこと。
(ウ)当該臨床研究において、比較対照技術より効果が増加することが、日本人を含む集団において統計学的に示されていること。
(二)対象品目の薬理作用等が比較対照技術と著しく異なること。
※3(1)類似薬効比較方式等により算定された医薬品
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1-β)
(2)原価計算方式により算定された医薬品(開示率が低いものに限る。)
価格調整後の価格 = 価格調整前の価格 - 有用性系加算部分 × (1- γ)- 営業利益部分 × (1-θ)
(3)別途、価格引下げの下限、価格引上げの上限のルールあり。
(4)価格調整に当たって、分析期間を超過した場合には、事前に企業に対して遅れた理由を確認した上で、その理由が妥当性を欠く場合については、最も小さな価格調整係数を用いることとする。
39