よむ、つかう、まなぶ。
資料4-3 リツキシマブ(遺伝子組換え) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
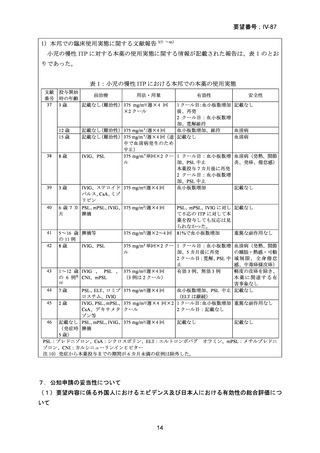
資料 4‐3
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
リツキシマブ(遺伝子組換え)
小児の慢性特発性血小板減少性紫斑病
1.要望内容の概略について
要 望 さ れ 一般名:リツキシマブ(遺伝子組換え)
た医薬品
販売名:リツキサン点滴静注 100 mg、リツキサン点滴静注 500 mg
会社名:全薬工業株式会社
要望者名
日本小児血液・がん学会
要望内容
効能・効果
小児の慢性特発性血小板減少性紫斑病
用法・用量
1 回あたり 375 mg/m2 を 1 週間間隔で計 4 回投与
効能・効果及び
用法・用量以外
の要望内容(剤
形追加等)
備考
小児に関する要望
2.要望内容における医療上の必要性について
(1)適応疾病の重篤性についての該当性
小児における慢性特発性血小板減少性紫斑病(以下、
「ITP」
)の病態は成人と同様であり、
血小板数が一定以下に減少すると、頭蓋内出血等の重篤かつ致死的な出血症状が出現する
場合もあることから、
「イ 病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患」
に該当すると判断した。
(2)医療上の有用性についての該当性
リツキシマブ(遺伝子組換え)
(以下、
「本薬」
)は、本邦において成人の慢性 ITP に係る
効能・効果で承認されている。慢性 ITP に係る本薬の効能・効果は欧米等 6 カ国で承認さ
れていないものの、米国及び欧州の診療ガイドラインにおいて成人及び小児の慢性 ITP に
対する二次治療として本薬の投与が推奨されている。国内の診療ガイドラインにおいても、
小児の慢性 ITP に対する二次治療として本薬の投与が推奨され、本薬の小児の慢性 ITP に
対する使用実績も認められることから、小児の慢性 ITP の治療体系における本薬の位置付
けは欧米と同様であると考える。以上より、
「ウ 欧米等において標準的療法に位置付けら
れており、国内外の医療環境の違い等を踏まえても国内における有用性が期待できると考
えられる」に該当すると判断した。
72 / 213
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
リツキシマブ(遺伝子組換え)
小児の慢性特発性血小板減少性紫斑病
1.要望内容の概略について
要 望 さ れ 一般名:リツキシマブ(遺伝子組換え)
た医薬品
販売名:リツキサン点滴静注 100 mg、リツキサン点滴静注 500 mg
会社名:全薬工業株式会社
要望者名
日本小児血液・がん学会
要望内容
効能・効果
小児の慢性特発性血小板減少性紫斑病
用法・用量
1 回あたり 375 mg/m2 を 1 週間間隔で計 4 回投与
効能・効果及び
用法・用量以外
の要望内容(剤
形追加等)
備考
小児に関する要望
2.要望内容における医療上の必要性について
(1)適応疾病の重篤性についての該当性
小児における慢性特発性血小板減少性紫斑病(以下、
「ITP」
)の病態は成人と同様であり、
血小板数が一定以下に減少すると、頭蓋内出血等の重篤かつ致死的な出血症状が出現する
場合もあることから、
「イ 病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患」
に該当すると判断した。
(2)医療上の有用性についての該当性
リツキシマブ(遺伝子組換え)
(以下、
「本薬」
)は、本邦において成人の慢性 ITP に係る
効能・効果で承認されている。慢性 ITP に係る本薬の効能・効果は欧米等 6 カ国で承認さ
れていないものの、米国及び欧州の診療ガイドラインにおいて成人及び小児の慢性 ITP に
対する二次治療として本薬の投与が推奨されている。国内の診療ガイドラインにおいても、
小児の慢性 ITP に対する二次治療として本薬の投与が推奨され、本薬の小児の慢性 ITP に
対する使用実績も認められることから、小児の慢性 ITP の治療体系における本薬の位置付
けは欧米と同様であると考える。以上より、
「ウ 欧米等において標準的療法に位置付けら
れており、国内外の医療環境の違い等を踏まえても国内における有用性が期待できると考
えられる」に該当すると判断した。
72 / 213