よむ、つかう、まなぶ。
資料4-3 リツキシマブ(遺伝子組換え) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
要望番号;IV-87
5)One year follow-up of children and adolescents with chronic immune thrombocytopenic purpura
(ITP) treated with rituximab.(Pediatr Blood Cancer 2009; 52: 259-62)10)
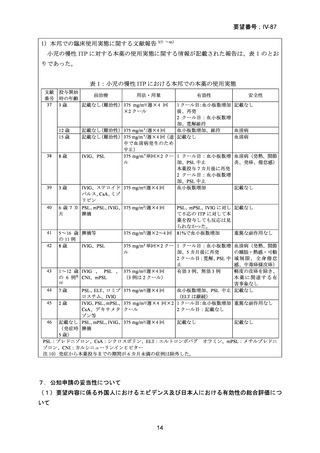
上記 2)の試験(Blood 2006; 107: 2639-4216))に組み入れられた 36 例(慢性 ITP 30 例注
4)
、Evans 症候群 6 例注 5))を対象に、本薬投与後の有効性の維持及び安全性が検討された。
有効性について、上記 2)の試験で有効と判定された 11 例のうち、1 年以上の観察期間
中、無治療で血小板数 150,000/µL 超を維持した被験者は 8 例であり、3 例では再発(血小
板数が 150,000/µL 超から減少し、治療が必要となった場合と定義)が認められた。
1 年間の観察期間中、無治療で血小板数が 150,000/µL を維持していた被験者 8 例では出
血の重症度(Blood 2006; 107: 2639-4216))が低く、重度の出血症状は発現せず、中等度の出
血症状が 3 例(6 件)に認められた。安全性について、本薬投与 12 週以降、本薬に関連す
る有害事象は認められなかった。
注 4)Buchanan と Adix によって開発された基準(J Pediatr 2002; 141: 683-8)によって ITP と診断された患者。
注 5)直接抗グロブリン試験陽性の自己免疫性溶血性貧血を伴う ITP である患者。
<日本における臨床試験等>
1)Long-term follow-up of children with refractory immune thrombocytopenia treated with rituximab.
(Int J Hematol 2014; 99: 429-36)26)
日本小児 ITP 研究会が行った全国アンケート調査及び日本小児血液・がん学会血小板小
委員会の小児血液疾患に関する疾患登録事業において本薬投与が確認された 18 歳未満の
22 例の治療抵抗性 ITP 患者注 6)を対象に、本薬の有効性の維持及び安全性について後方視
的に検討された。
22 例全例が 1 回以上の IVIG 及び副腎皮質ステロイドによる治療歴を有し、本薬初回投
与時の年齢は 0~17 歳であり、4 例が脾摘を受けていた。
本薬 375 mg/m2 を 1 週間間隔で複数回投与された症例は 18 例であり、投与回数の内訳
は、4 回が 15 例、3 回が 2 例、2 回が 1 例であった。また、本薬 375 mg/m2 を単回投与され
た症例が 2 例、本薬 375 mg/m2 を 4 週間間隔で 2 回投与された症例が 1 例、本薬 100 mg を
1 週間間隔で 4 回投与された症例が 1 例であった。
有効性について、本薬投与開始後に 4 週間、血小板数 100,000/μL 以上が持続した場合を
完全奏効、血小板数 30,000~99,000/μL が持続した場合を部分奏効と定義することとされ
た。その結果、完全奏効及び部分奏効の被験者の割合は、それぞれ 41%(9/22 例)及び 9%
(2/22 例)であり、両者を合わせた全体の奏効割合は 50%(11/22 例)であった。奏効例に
おける、治療開始 1 年後、2 年後及び 5 年後の完全奏効割合は、それぞれ 55%、36%及び
27%であった。
また、6 例で本薬による再治療が行われ、再治療の回数及びその内訳は 1 回が 4 例(初
回投与時に無反応だった 1 例を含む)、2 回が 1 例、3 回が 1 例であった。初回治療時に完
全奏効又は部分奏効だった 5 例では、3 回再治療を行った 1 例の 3 回目の再治療時を除き、
再治療時に完全奏効が得られた。初回治療時に無反応だった 1 例では、再治療時に本薬、
8
79 / 213
5)One year follow-up of children and adolescents with chronic immune thrombocytopenic purpura
(ITP) treated with rituximab.(Pediatr Blood Cancer 2009; 52: 259-62)10)
上記 2)の試験(Blood 2006; 107: 2639-4216))に組み入れられた 36 例(慢性 ITP 30 例注
4)
、Evans 症候群 6 例注 5))を対象に、本薬投与後の有効性の維持及び安全性が検討された。
有効性について、上記 2)の試験で有効と判定された 11 例のうち、1 年以上の観察期間
中、無治療で血小板数 150,000/µL 超を維持した被験者は 8 例であり、3 例では再発(血小
板数が 150,000/µL 超から減少し、治療が必要となった場合と定義)が認められた。
1 年間の観察期間中、無治療で血小板数が 150,000/µL を維持していた被験者 8 例では出
血の重症度(Blood 2006; 107: 2639-4216))が低く、重度の出血症状は発現せず、中等度の出
血症状が 3 例(6 件)に認められた。安全性について、本薬投与 12 週以降、本薬に関連す
る有害事象は認められなかった。
注 4)Buchanan と Adix によって開発された基準(J Pediatr 2002; 141: 683-8)によって ITP と診断された患者。
注 5)直接抗グロブリン試験陽性の自己免疫性溶血性貧血を伴う ITP である患者。
<日本における臨床試験等>
1)Long-term follow-up of children with refractory immune thrombocytopenia treated with rituximab.
(Int J Hematol 2014; 99: 429-36)26)
日本小児 ITP 研究会が行った全国アンケート調査及び日本小児血液・がん学会血小板小
委員会の小児血液疾患に関する疾患登録事業において本薬投与が確認された 18 歳未満の
22 例の治療抵抗性 ITP 患者注 6)を対象に、本薬の有効性の維持及び安全性について後方視
的に検討された。
22 例全例が 1 回以上の IVIG 及び副腎皮質ステロイドによる治療歴を有し、本薬初回投
与時の年齢は 0~17 歳であり、4 例が脾摘を受けていた。
本薬 375 mg/m2 を 1 週間間隔で複数回投与された症例は 18 例であり、投与回数の内訳
は、4 回が 15 例、3 回が 2 例、2 回が 1 例であった。また、本薬 375 mg/m2 を単回投与され
た症例が 2 例、本薬 375 mg/m2 を 4 週間間隔で 2 回投与された症例が 1 例、本薬 100 mg を
1 週間間隔で 4 回投与された症例が 1 例であった。
有効性について、本薬投与開始後に 4 週間、血小板数 100,000/μL 以上が持続した場合を
完全奏効、血小板数 30,000~99,000/μL が持続した場合を部分奏効と定義することとされ
た。その結果、完全奏効及び部分奏効の被験者の割合は、それぞれ 41%(9/22 例)及び 9%
(2/22 例)であり、両者を合わせた全体の奏効割合は 50%(11/22 例)であった。奏効例に
おける、治療開始 1 年後、2 年後及び 5 年後の完全奏効割合は、それぞれ 55%、36%及び
27%であった。
また、6 例で本薬による再治療が行われ、再治療の回数及びその内訳は 1 回が 4 例(初
回投与時に無反応だった 1 例を含む)、2 回が 1 例、3 回が 1 例であった。初回治療時に完
全奏効又は部分奏効だった 5 例では、3 回再治療を行った 1 例の 3 回目の再治療時を除き、
再治療時に完全奏効が得られた。初回治療時に無反応だった 1 例では、再治療時に本薬、
8
79 / 213