よむ、つかう、まなぶ。
08参考資料1-2ワクチン評価小委資料「ファイザー株式会社提出資料」[1.4MB] (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41548.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第61回 7/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
B7471011
試験デザイン: 乳幼児を対象とした海外第3相試験
試験概要
年齢
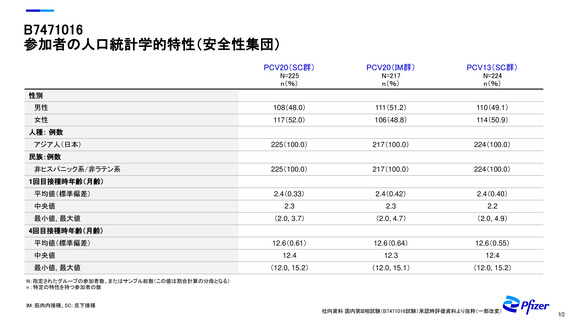
参加者の人口統計学的特性(安全性集団)
多施設共同、二重盲検、無作為化、実薬対照試験(米国/プエルトリコ)
2か月齢
4か月齢
6か月齢
7か月齢
12~15
か月齢
13~16
か月齢
PCV20
N=1001
n(%)
PCV13
N=987
n(%)
518(51.7)
505(51.2)
白人
754(75.3)
742(75.2)
黒人又はアフリカ系
アメリカ人
110(11.0)
108(10.9)
アジア人
16(1.6)
16(1.6)
アメリカンインディアン
又はアラスカ先住民
4(0.4)
3(0.3)
ハワイ先住民又は
太平洋諸島人
2(0.2)
2(0.2)
Multiracial
68(6.8)
73(7.4)
ヒスパニック系/ラテン系
312(31.2)
293(29.7)
非ヒスパニック系/
非ラテン系
661(66.0)
659(66.8)
18~21
か月齢
PCV20 IM群
Sex
男性
PCV20
PCV20
PCV20
+
Pediarix, Hib
+
Pediarix, Hib
+
Pediarix, Hib
PCV20
Race
+
MMR及びVaricella
PCV13 IM群
採血
PCV13
PCV13
PCV13
+
Pediarix, Hib
+
Pediarix, Hib
+
Pediarix, Hib
安全性追跡調査(電話連絡)
PCV13
+
MMR及びVaricella
インフルエンザワクチンとロタウイルスワクチンの併用は試験期間中いつでも可
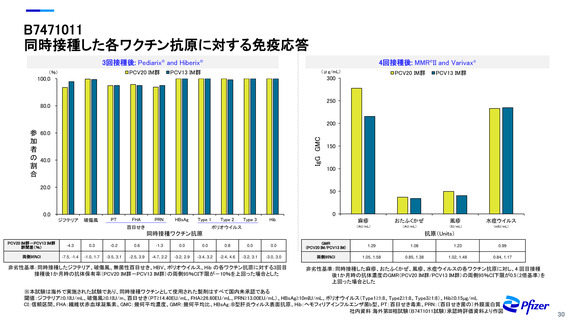
目 的 乳幼児でのPCV20の安全性を評価し、PCV20と既承認のPCV13の免疫原性に関する主要な比較を行う
対 象 生後2か月の乳幼児(組み入れ時:生後42~98日):1997例(組み入れ例数)
方 法 各群の生後2、4、6及び12~15か月時の間にPCV20 0.5mL/回又はPCV13 0.5mL/回を筋肉内接種※1(合計4回)した。
同時接種ワクチンとして、 1~3回目にジフテリア、破傷風、無菌体百日せき、HBV、ポリオウイルス、Hibの各抗原を含有する特定のワクチンを接種
し、4回目にMMR、水痘の各抗原を含有するワクチンを接種※2した。
※1:PCV13筋肉内投与:国内未承認。
※2:本試験は海外で実施された試験であり、同時接種ワクチンとして使用された製剤はすべて国内未承認である。
PCV13:13価肺炎球菌結合型ワクチン、PCV20:20価肺炎球菌結合型ワクチン
HBV:B型肝炎ウイルス、Hib:ヘモフィリスインフルエンザ菌b型、MMR:麻疹・おたふくかぜ・風疹、IM:筋肉内接種
Ethnicity
N:指定されたグループの参加者数、またはサンプル総数. (この値は割合計算の分母となる)
n:特定の特性を持つ参加者の数.
社内資料 海外第III相試験(B7471011試験)承認時評価資料より作図
23
試験デザイン: 乳幼児を対象とした海外第3相試験
試験概要
年齢
参加者の人口統計学的特性(安全性集団)
多施設共同、二重盲検、無作為化、実薬対照試験(米国/プエルトリコ)
2か月齢
4か月齢
6か月齢
7か月齢
12~15
か月齢
13~16
か月齢
PCV20
N=1001
n(%)
PCV13
N=987
n(%)
518(51.7)
505(51.2)
白人
754(75.3)
742(75.2)
黒人又はアフリカ系
アメリカ人
110(11.0)
108(10.9)
アジア人
16(1.6)
16(1.6)
アメリカンインディアン
又はアラスカ先住民
4(0.4)
3(0.3)
ハワイ先住民又は
太平洋諸島人
2(0.2)
2(0.2)
Multiracial
68(6.8)
73(7.4)
ヒスパニック系/ラテン系
312(31.2)
293(29.7)
非ヒスパニック系/
非ラテン系
661(66.0)
659(66.8)
18~21
か月齢
PCV20 IM群
Sex
男性
PCV20
PCV20
PCV20
+
Pediarix, Hib
+
Pediarix, Hib
+
Pediarix, Hib
PCV20
Race
+
MMR及びVaricella
PCV13 IM群
採血
PCV13
PCV13
PCV13
+
Pediarix, Hib
+
Pediarix, Hib
+
Pediarix, Hib
安全性追跡調査(電話連絡)
PCV13
+
MMR及びVaricella
インフルエンザワクチンとロタウイルスワクチンの併用は試験期間中いつでも可
目 的 乳幼児でのPCV20の安全性を評価し、PCV20と既承認のPCV13の免疫原性に関する主要な比較を行う
対 象 生後2か月の乳幼児(組み入れ時:生後42~98日):1997例(組み入れ例数)
方 法 各群の生後2、4、6及び12~15か月時の間にPCV20 0.5mL/回又はPCV13 0.5mL/回を筋肉内接種※1(合計4回)した。
同時接種ワクチンとして、 1~3回目にジフテリア、破傷風、無菌体百日せき、HBV、ポリオウイルス、Hibの各抗原を含有する特定のワクチンを接種
し、4回目にMMR、水痘の各抗原を含有するワクチンを接種※2した。
※1:PCV13筋肉内投与:国内未承認。
※2:本試験は海外で実施された試験であり、同時接種ワクチンとして使用された製剤はすべて国内未承認である。
PCV13:13価肺炎球菌結合型ワクチン、PCV20:20価肺炎球菌結合型ワクチン
HBV:B型肝炎ウイルス、Hib:ヘモフィリスインフルエンザ菌b型、MMR:麻疹・おたふくかぜ・風疹、IM:筋肉内接種
Ethnicity
N:指定されたグループの参加者数、またはサンプル総数. (この値は割合計算の分母となる)
n:特定の特性を持つ参加者の数.
社内資料 海外第III相試験(B7471011試験)承認時評価資料より作図
23