よむ、つかう、まなぶ。
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
に対する不利益とのバランスを考慮する必要がある。
⚫ 安全性の確認は重要であるものの、数名の日本人のデータがないことでど
れだけの安全性を損ねるのか。PK/PD をとっても人種差よりも日本人で
の個人差の方が大きい場合もあるので、少人数の試験の意義をよく考える
必要がある。
⚫ 第Ⅰ相試験をスキップするとしても、国際共同治験に参加した日本人から
PK/PD データを収集することもできるのではないか。
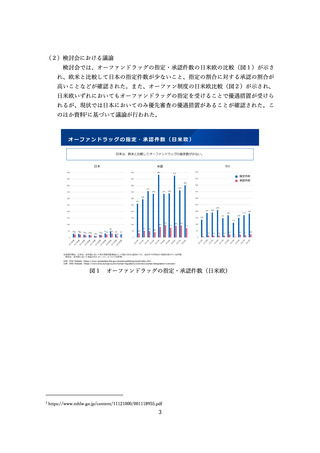
⚫ ブロックバスターになるような医薬品ではなく、オーファンドラッグなど
患者数が少なくて開発されにくいものなど、疾患自体や治療薬がないこと
のリスクの方がより高いと考えられるものについては、不要としてもいい
のではないか。
⚫ ブロックバスターになるような医薬品では日本からもなるべく多くの被験
者の方に後期の臨床試験に参加していただき、日本の医療実態の中でのそ
の薬の有効性・安全性を確認するのが良いのではないか。
⚫ PMDA が、相談対応において、直接的な表現を避け、婉曲的な表現により
見解を示すことで、そうした表現に不慣れで、かつ通訳を介してコミュニ
ケーションを行う海外ベンチャーに対して、PMDA の真意が適切に伝わら
ず、第Ⅰ相試験をしなければ国際共同試験に日本から参加できないといっ
た誤解が生じている場合があるのではないか。
⚫ ケースバイケースの検討が必要であるため、要否の判断にあたって考慮す
る要素を単に文章化するだけでは解決しない。例えば、先行する海外試験
で複数の人種、様々な体格で検討がなされた結果大きな違いがなければ、
日本人での第Ⅰ相試験については、企業の判断で実施しないことを認めて
もよいのではないか。
⚫ 科学的な議論を PMDA がした場合に、安全性の観点から保守的な判断とな
るのはやむを得ない。医薬品を待っている患者さんへの配慮と開発におい
てどの程度の不確実性までなら許容できるかのバランスの問題であり、科
学のみの話ではないことから、厚生労働省として例えば原則不要とするな
どの政策判断をするべき。
⚫ 必要な場合、又は不要な場合の事例を可能な限り明示することとしてはど
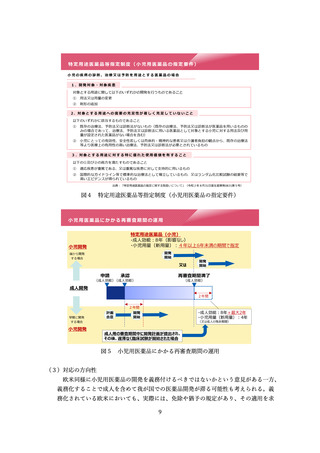
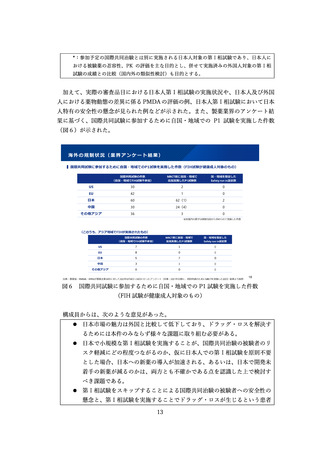
うか。特に、アンメットメディカルニーズなど、日本での開発が進みにく
い品目をその事例としてあげることは重要である。その場合も、日本人の
PK に関する情報は重要であり、後からでも解析を行うことが必要。
⚫ PMDA のこれまでの経験を整理し、ディシジョンツリーを作成して文書化
し、ベンチャー企業と共有するべき。リスクベースドアプローチの考え方
に基づき議論ができるよう、考慮すべき要素を開発者と審査側で共有すべ
き。
14
⚫ 安全性の確認は重要であるものの、数名の日本人のデータがないことでど
れだけの安全性を損ねるのか。PK/PD をとっても人種差よりも日本人で
の個人差の方が大きい場合もあるので、少人数の試験の意義をよく考える
必要がある。
⚫ 第Ⅰ相試験をスキップするとしても、国際共同治験に参加した日本人から
PK/PD データを収集することもできるのではないか。
⚫ ブロックバスターになるような医薬品ではなく、オーファンドラッグなど
患者数が少なくて開発されにくいものなど、疾患自体や治療薬がないこと
のリスクの方がより高いと考えられるものについては、不要としてもいい
のではないか。
⚫ ブロックバスターになるような医薬品では日本からもなるべく多くの被験
者の方に後期の臨床試験に参加していただき、日本の医療実態の中でのそ
の薬の有効性・安全性を確認するのが良いのではないか。
⚫ PMDA が、相談対応において、直接的な表現を避け、婉曲的な表現により
見解を示すことで、そうした表現に不慣れで、かつ通訳を介してコミュニ
ケーションを行う海外ベンチャーに対して、PMDA の真意が適切に伝わら
ず、第Ⅰ相試験をしなければ国際共同試験に日本から参加できないといっ
た誤解が生じている場合があるのではないか。
⚫ ケースバイケースの検討が必要であるため、要否の判断にあたって考慮す
る要素を単に文章化するだけでは解決しない。例えば、先行する海外試験
で複数の人種、様々な体格で検討がなされた結果大きな違いがなければ、
日本人での第Ⅰ相試験については、企業の判断で実施しないことを認めて
もよいのではないか。
⚫ 科学的な議論を PMDA がした場合に、安全性の観点から保守的な判断とな
るのはやむを得ない。医薬品を待っている患者さんへの配慮と開発におい
てどの程度の不確実性までなら許容できるかのバランスの問題であり、科
学のみの話ではないことから、厚生労働省として例えば原則不要とするな
どの政策判断をするべき。
⚫ 必要な場合、又は不要な場合の事例を可能な限り明示することとしてはど
うか。特に、アンメットメディカルニーズなど、日本での開発が進みにく
い品目をその事例としてあげることは重要である。その場合も、日本人の
PK に関する情報は重要であり、後からでも解析を行うことが必要。
⚫ PMDA のこれまでの経験を整理し、ディシジョンツリーを作成して文書化
し、ベンチャー企業と共有するべき。リスクベースドアプローチの考え方
に基づき議論ができるよう、考慮すべき要素を開発者と審査側で共有すべ
き。
14