よむ、つかう、まなぶ。
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
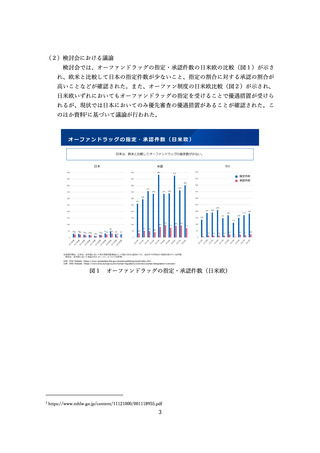
【現在に至るまで】
希少疾患等に用いる医薬品について外国で検証的な臨床試験結果が得られている
場合などには、承認申請にあたり PMDA との対面助言を活用するなどした上で、
日本人患者の投与経験の蓄積の観点から少数例の忍容性を確認する試験や少数の日
本人患者で安全性・有効性を評価する試験を可能な限り実施してきた。
【提案】
適切にデザインされた海外臨床試験の結果や類薬の情報を含めた既存の知見、モ
デリング&シミュレーション等に基づき日本人での用法・用量並びに有効性・安全
性が説明可能な場合、改めて日本人での少数例の試験を行わずに、海外で実施され
た臨床試験等で臨床データパッケージを構成できると考える。
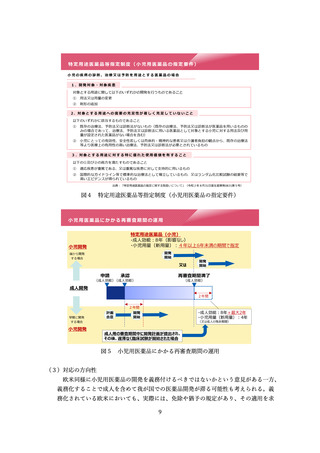
【提案の背景】
⚫ 少数例の日本人の試験では、安全性や有効性を評価することは難しく、ま
た推定精度も低いことから、外国の臨床試験成績と比較して明確な結論を
導くことは困難である。
⚫ 試験の立ち上げに際しては、プロトコール、治験薬概要書、同意文書、
EDC、検査資材、治験薬などの準備にかかる労力・コストは、ごく小規模
な試験であっても大きな相違はない。
⚫ なお、製販後については、今後の検討会のテーマである「製造販売後に実
施する使用成績調査等のあり方」において、これまでの一律的な全例調
査、使用成績調査等とするよりも、海外の安全性監視活動からのデータも
活用し、安全対策に寄与する効果的な安全性監視活動にすることが重要で
ある旨について議論したい。
このほか、超希少疾患であって少ない日本人症例数で承認された事例や、これまで
の国際共同治験に係る考え方等が示された。
構成員からは、次のような意見が出た。
▍日本人データの必要性について
⚫ 小児癌などの超希少疾患であっても全て日本人治験を行う必要がないとは
思わない。これから行われる国際共同治験であれば参加すべき。
⚫ 医療現場としては日本人症例は必要という感覚。超希少疾患で、海外で検
証的試験が実施済みであれば、日本人の治験がなくとも仕方ない感覚はあ
るが、治験の空洞化という意味での心配もある。
⚫ 少数例であっても国際共同治験に参加した経験を通じて、医療機関での経
験・ノウハウの蓄積に繋がった。一方で、経験・ノウハウの蓄積は別の方
19
希少疾患等に用いる医薬品について外国で検証的な臨床試験結果が得られている
場合などには、承認申請にあたり PMDA との対面助言を活用するなどした上で、
日本人患者の投与経験の蓄積の観点から少数例の忍容性を確認する試験や少数の日
本人患者で安全性・有効性を評価する試験を可能な限り実施してきた。
【提案】
適切にデザインされた海外臨床試験の結果や類薬の情報を含めた既存の知見、モ
デリング&シミュレーション等に基づき日本人での用法・用量並びに有効性・安全
性が説明可能な場合、改めて日本人での少数例の試験を行わずに、海外で実施され
た臨床試験等で臨床データパッケージを構成できると考える。
【提案の背景】
⚫ 少数例の日本人の試験では、安全性や有効性を評価することは難しく、ま
た推定精度も低いことから、外国の臨床試験成績と比較して明確な結論を
導くことは困難である。
⚫ 試験の立ち上げに際しては、プロトコール、治験薬概要書、同意文書、
EDC、検査資材、治験薬などの準備にかかる労力・コストは、ごく小規模
な試験であっても大きな相違はない。
⚫ なお、製販後については、今後の検討会のテーマである「製造販売後に実
施する使用成績調査等のあり方」において、これまでの一律的な全例調
査、使用成績調査等とするよりも、海外の安全性監視活動からのデータも
活用し、安全対策に寄与する効果的な安全性監視活動にすることが重要で
ある旨について議論したい。
このほか、超希少疾患であって少ない日本人症例数で承認された事例や、これまで
の国際共同治験に係る考え方等が示された。
構成員からは、次のような意見が出た。
▍日本人データの必要性について
⚫ 小児癌などの超希少疾患であっても全て日本人治験を行う必要がないとは
思わない。これから行われる国際共同治験であれば参加すべき。
⚫ 医療現場としては日本人症例は必要という感覚。超希少疾患で、海外で検
証的試験が実施済みであれば、日本人の治験がなくとも仕方ない感覚はあ
るが、治験の空洞化という意味での心配もある。
⚫ 少数例であっても国際共同治験に参加した経験を通じて、医療機関での経
験・ノウハウの蓄積に繋がった。一方で、経験・ノウハウの蓄積は別の方
19