よむ、つかう、まなぶ。
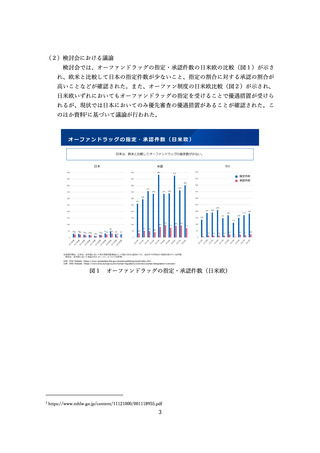
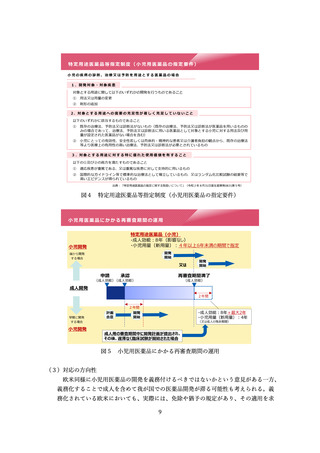
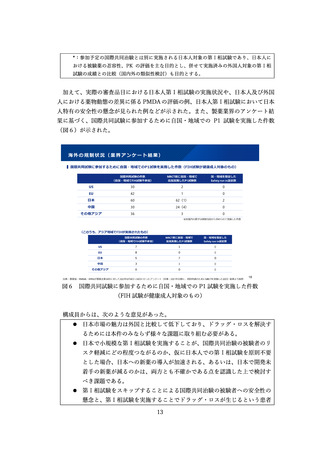
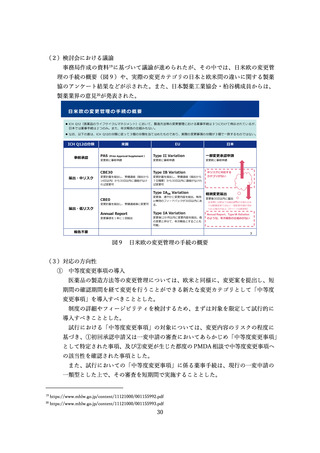
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3)対応の方向性
①
リサーチクエスチョンの設定と適切な対処方法の検討について
リサーチクエスチョンの設定の在り方及び製造販売後調査等の計画検討時期につ
いては、引き続き製薬業界・行政間での議論を継続すべきこととした。
少なくとも、単に治験の症例数が少ないことや一部の患者集団における情報が不
足していることのみがリサーチクエスチョンである場合には、使用成績調査を実施
する根拠となるものではないこと、これらを背景として単に特定された重大なリス
クに相当する副作用の頻度調査のみを行うために使用成績調査を実施することが適
切な対処方法とはならないことを明確化することとした。
また、少なくとも、製造販売後調査等を実施することが再審査期間の付与の前提
となるものではないことを明確化することとした。
使用成績調査は、重要な特定されたリスクについて、その頻度調査を目的として
行うことの意義は限られており、基本的には、重要な潜在的なリスク、重要な不足
情報に関する調査を目的として行うことが想定されるものであることを明確化する
こととした。
②
製造販売後調査等の計画検討時期について
製造販売後調査等の実施計画については、承認時に具体的なリサーチクエスチョ
ンがある場合には、承認前に検討することとし、それ以外の場合には、承認前では
なく、市販後の適切な時期(例えば、市販直後調査のデータが得られた時点や、新
たな安全性情報が得られた時点で新たなリサーチクエスチョンが見いだされた場合)
に、その要否を含め、検討することとした。
③
全例調査の対象について
単に日本人の治験の症例数が少ないことのみを理由とした全例調査は、原則とし
て行わないこととした。例えば、次のような場合には、一律には全例調査を実施し
ないことを考慮してよいこととした。
日本人を対象とした治験の症例数は限られているものの、海外での治験を含め
相応の安全性情報があり、安全性にかかる国内外の民族差の懸念がないもの。
作用機序が同様の類薬での使用実績から一定の安全性情報があり、一定の評価
を受けているもの。
適応追加に係る申請に基づく調査であり、製剤としての使用実績から一定の安
全性に係る情報があり、既存の適応症との安全性プロファイルに差異について
懸念がないもの。
また、リスク最小化を目的とした全例調査は、行わないこととする。なお、リス
ク最小化には、従前どおり市販直後調査や医療機関や医師の要件の設定等を活用す
ることとした。
28
①
リサーチクエスチョンの設定と適切な対処方法の検討について
リサーチクエスチョンの設定の在り方及び製造販売後調査等の計画検討時期につ
いては、引き続き製薬業界・行政間での議論を継続すべきこととした。
少なくとも、単に治験の症例数が少ないことや一部の患者集団における情報が不
足していることのみがリサーチクエスチョンである場合には、使用成績調査を実施
する根拠となるものではないこと、これらを背景として単に特定された重大なリス
クに相当する副作用の頻度調査のみを行うために使用成績調査を実施することが適
切な対処方法とはならないことを明確化することとした。
また、少なくとも、製造販売後調査等を実施することが再審査期間の付与の前提
となるものではないことを明確化することとした。
使用成績調査は、重要な特定されたリスクについて、その頻度調査を目的として
行うことの意義は限られており、基本的には、重要な潜在的なリスク、重要な不足
情報に関する調査を目的として行うことが想定されるものであることを明確化する
こととした。
②
製造販売後調査等の計画検討時期について
製造販売後調査等の実施計画については、承認時に具体的なリサーチクエスチョ
ンがある場合には、承認前に検討することとし、それ以外の場合には、承認前では
なく、市販後の適切な時期(例えば、市販直後調査のデータが得られた時点や、新
たな安全性情報が得られた時点で新たなリサーチクエスチョンが見いだされた場合)
に、その要否を含め、検討することとした。
③
全例調査の対象について
単に日本人の治験の症例数が少ないことのみを理由とした全例調査は、原則とし
て行わないこととした。例えば、次のような場合には、一律には全例調査を実施し
ないことを考慮してよいこととした。
日本人を対象とした治験の症例数は限られているものの、海外での治験を含め
相応の安全性情報があり、安全性にかかる国内外の民族差の懸念がないもの。
作用機序が同様の類薬での使用実績から一定の安全性情報があり、一定の評価
を受けているもの。
適応追加に係る申請に基づく調査であり、製剤としての使用実績から一定の安
全性に係る情報があり、既存の適応症との安全性プロファイルに差異について
懸念がないもの。
また、リスク最小化を目的とした全例調査は、行わないこととする。なお、リス
ク最小化には、従前どおり市販直後調査や医療機関や医師の要件の設定等を活用す
ることとした。
28