よむ、つかう、まなぶ。
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(4)検討会後の対応状況
検討会の議論を踏まえ、次の通知を発出した。なお、これらの通知については、英
訳を作成して同時に発出した。
・「海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験
の実施に関する基本的考え方について」
(令和 5 年 12 月 25 日医薬薬審発 1225 第2
号厚生労働省医薬局医薬品審査管理課長通知)
・「海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験
の実施に関する基本的考え方についての質疑応答集について」(令和 5 年 12 月 25 日
厚生労働省医薬局医薬品審査管理課事務連絡)
5.検証的試験等における日本人データの必要性の整理及び迅速な承認制度のあり方につ
いて
(1)背景
<検証的試験における日本人データの必要性の整理について>
新薬の開発はグローバル化が進み、国際共同治験の実施により世界同時開発するこ
とが主流となっている。また、日本が国際共同治験に参加できなかった場合には、日
本人での有効性・安全性を確認するために、国内での臨床試験を実施した上で承認申
請されることが通常である。
このため、国際共同治験への日本の参加を含めた国内での臨床試験が円滑に実施さ
れるよう、治験を実施しやすい環境作りなど我が国の創薬力向上を図ることが重要で
ある。
一方、例えば、患者数の極めて少ない、いわゆる超希少疾患においては、国際共同
試験や国内試験において組み入れられる日本人の症例数が極めて少なく、国際共同治
験や海外試験との一貫性・類似性を評価するには情報量が乏しい場合もある。これま
では、日本人のデータが集団としての評価が難しい程度に少なくても、個々の被験者
の詳細な医学的情報をみて日本人に外国人のデータを当てはめることができるか精査
してきた。
このような場合における日本人の臨床試験データの必要性について、少数例であっ
ても医療現場への情報提供を求める意見や、創薬力向上の観点を踏まえ、検討した。
<迅速な承認制度のあり方について>
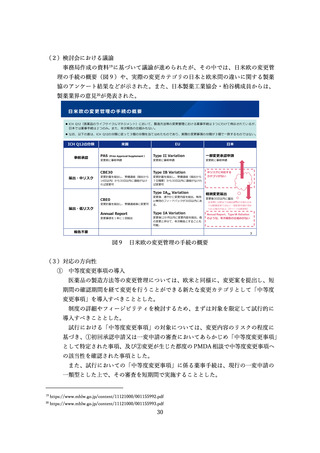
医療上の必要性の高い希少・重篤な疾患に対する医薬品については、検証的試験結
果を待たず、探索的な試験結果に基づいて薬事承認を行う制度が、日米欧において設
けられている(表1)
。
17
検討会の議論を踏まえ、次の通知を発出した。なお、これらの通知については、英
訳を作成して同時に発出した。
・「海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験
の実施に関する基本的考え方について」
(令和 5 年 12 月 25 日医薬薬審発 1225 第2
号厚生労働省医薬局医薬品審査管理課長通知)
・「海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験
の実施に関する基本的考え方についての質疑応答集について」(令和 5 年 12 月 25 日
厚生労働省医薬局医薬品審査管理課事務連絡)
5.検証的試験等における日本人データの必要性の整理及び迅速な承認制度のあり方につ
いて
(1)背景
<検証的試験における日本人データの必要性の整理について>
新薬の開発はグローバル化が進み、国際共同治験の実施により世界同時開発するこ
とが主流となっている。また、日本が国際共同治験に参加できなかった場合には、日
本人での有効性・安全性を確認するために、国内での臨床試験を実施した上で承認申
請されることが通常である。
このため、国際共同治験への日本の参加を含めた国内での臨床試験が円滑に実施さ
れるよう、治験を実施しやすい環境作りなど我が国の創薬力向上を図ることが重要で
ある。
一方、例えば、患者数の極めて少ない、いわゆる超希少疾患においては、国際共同
試験や国内試験において組み入れられる日本人の症例数が極めて少なく、国際共同治
験や海外試験との一貫性・類似性を評価するには情報量が乏しい場合もある。これま
では、日本人のデータが集団としての評価が難しい程度に少なくても、個々の被験者
の詳細な医学的情報をみて日本人に外国人のデータを当てはめることができるか精査
してきた。
このような場合における日本人の臨床試験データの必要性について、少数例であっ
ても医療現場への情報提供を求める意見や、創薬力向上の観点を踏まえ、検討した。
<迅速な承認制度のあり方について>
医療上の必要性の高い希少・重篤な疾患に対する医薬品については、検証的試験結
果を待たず、探索的な試験結果に基づいて薬事承認を行う制度が、日米欧において設
けられている(表1)
。
17