よむ、つかう、まなぶ。
参考資料4:総薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会報告書 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43236.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第36回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
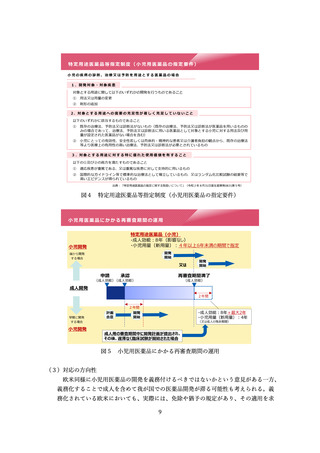
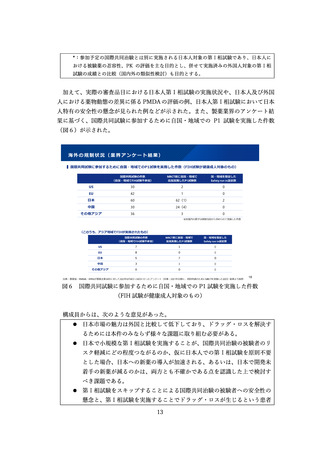
性を踏まえつつ、異なる治療ラインや、異なる疾患の進行段階であっても認められる
場合があるものとする。また、必ずしも日本人が含まれる必要はなく、海外で実施中
又は計画されている検証的臨床試験が認められる場合があるものとする。
なお、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件のあり方
や、承認後の取消のあり方を含めた、条件付き承認の制度的枠組みのあり方について
は、引き続き、法改正の要否も含め、検討を進めるべきものとする。また、市販後の
評価に係る PMDA の体制強化についても、併せて検討を進めるべきものとする。
加えて、条件付き承認の活用を図るため、試行的なパイロット事業として、一つの
方策として、審査の過程でアカデミアや患者団体の意見を反映する仕組みについて研
究を進めるべきこととされた。
(4)検討会後の対応状況
検討会の議論を踏まえ、具体的な通知化に向けて、行政・業界間で議論が継続され
ている。
6.治験の更なる効率化(エコシステム)について
(1)背景
日本の治験環境については、これまで、「臨床研究・治験活性化5か年計画 2012」
(平成 24 年3月 30 日文部科学省・厚生労働省)、
「臨床研究・治験の推進に関する今
後の方向性について(2019 年版)とりまとめ」
(令和元年 12 月6日 厚生労働省)等
に基づき、その改善に向けた取り組みが行われてきたが、現在でも海外と比べると実
施しにくい側面があると言われている。
また、近年、分散型治験やプラットフォーム型治験など、新たな形態の治験が行わ
れるようになっており、被験者の保護及び治験の科学的な質の確保を前提としつつ、
また、現在、改定作業中の ICH-E6(R3)の動向にも留意しつつ環境変化に対応した
規制のあり方を検討する必要がある。
令和4年度厚生労働科学特別研究事業「国内外の治験をとりまく環境に係る最新の
動向調査研究」(研究代表者:国立がん研究センター東病院臨床研究支援部門長
佐
藤暁洋)において、日本の治験環境については、海外と比較して、データ入力や逸脱
等のクオリティや、被験者登録数のスピードにおいては海外と大きな違いはないが、
コスト面での違いが大きいことが指摘されており、これを解決するために、
①
中央 IRB の普及
②
治験実施の更なる合理化
③
治験費用の算定方法の合理化
が必要である提言されている。
また、厚生労働省が製薬企業や CRO 等に対して行ったヒアリングにおいても、同
様の点が指摘されており、これらの課題について対応策を検討した。
24
場合があるものとする。また、必ずしも日本人が含まれる必要はなく、海外で実施中
又は計画されている検証的臨床試験が認められる場合があるものとする。
なお、「検証的臨床試験の実施が困難又は相当の時間を要する」との要件のあり方
や、承認後の取消のあり方を含めた、条件付き承認の制度的枠組みのあり方について
は、引き続き、法改正の要否も含め、検討を進めるべきものとする。また、市販後の
評価に係る PMDA の体制強化についても、併せて検討を進めるべきものとする。
加えて、条件付き承認の活用を図るため、試行的なパイロット事業として、一つの
方策として、審査の過程でアカデミアや患者団体の意見を反映する仕組みについて研
究を進めるべきこととされた。
(4)検討会後の対応状況
検討会の議論を踏まえ、具体的な通知化に向けて、行政・業界間で議論が継続され
ている。
6.治験の更なる効率化(エコシステム)について
(1)背景
日本の治験環境については、これまで、「臨床研究・治験活性化5か年計画 2012」
(平成 24 年3月 30 日文部科学省・厚生労働省)、
「臨床研究・治験の推進に関する今
後の方向性について(2019 年版)とりまとめ」
(令和元年 12 月6日 厚生労働省)等
に基づき、その改善に向けた取り組みが行われてきたが、現在でも海外と比べると実
施しにくい側面があると言われている。
また、近年、分散型治験やプラットフォーム型治験など、新たな形態の治験が行わ
れるようになっており、被験者の保護及び治験の科学的な質の確保を前提としつつ、
また、現在、改定作業中の ICH-E6(R3)の動向にも留意しつつ環境変化に対応した
規制のあり方を検討する必要がある。
令和4年度厚生労働科学特別研究事業「国内外の治験をとりまく環境に係る最新の
動向調査研究」(研究代表者:国立がん研究センター東病院臨床研究支援部門長
佐
藤暁洋)において、日本の治験環境については、海外と比較して、データ入力や逸脱
等のクオリティや、被験者登録数のスピードにおいては海外と大きな違いはないが、
コスト面での違いが大きいことが指摘されており、これを解決するために、
①
中央 IRB の普及
②
治験実施の更なる合理化
③
治験費用の算定方法の合理化
が必要である提言されている。
また、厚生労働省が製薬企業や CRO 等に対して行ったヒアリングにおいても、同
様の点が指摘されており、これらの課題について対応策を検討した。
24